题目内容
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i. CH2=CHCH,3(g)+Cl2(g)![]() CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
ii. CH2=CHCH,3(g)+Cl2(g)![]() CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
已知:相关化学键的键能数据如下表所示:
化学键 | C—C | C—C | C—Cl | Cl—Cl |
E/( kJ mol-1) | 611 | x | 328 | 243 |
请回答下列问题:
(1)由反应i计算出表中x=_____________。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHC1CH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HC1,只发生反应CH2=CH CH2Cl (g)+HCl(g)![]() CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
①平衡时,HCl的体积分数为__________________(保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0. 6 mol CH2=CHCH2Cl、0.2molHC1和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)______________ (填“>”“<”或“=”)V逆(HCl).
(4)一定压强下,向密闭容器中充入一定量的CH2=CHCH3和C12发生反应ii。设起始的![]() =w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
=w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
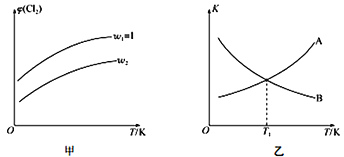
①图甲中,w2__________(填“>”“<”或“=”)1
②图乙中,表示正反应平衡常数的曲线为____________(填“A”或“B”),理由为________________。
③T1K下,平衡时a(Cl2)= ________________。
(5)起始时向某恒容绝热容器中充入1 mol CH2 =CHCH3和1 mol Cl2发生反应ii,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
【答案】 332 增大 增大压强,反应ii的平衡不移动,反应i的平衡正向移动。所以CH2C1CHC1CH3的产率增大 54.5% > > B 反应ii的正反应为放热反应。温度升高, 正反应的平衡常数减小 50% 增大
【解析】这是考查化学反应原理的的题目,考查热化学,化学键,化学平衡等知识点。
(1) 由 反 应 i ,ΔH1 = -134 k J· mol -1 =611k J·mol -1 + 243k J·mol -1- x - 2×328k J·mol -1,
解得x=332k J·mol -1。
(2)反应ii的左右两边气体分子总数相等,平衡不受压强影响;反应i为 气 体 分 子 总 数 减 小 的 反 应,增大压强,平衡正向移动,CH2ClCHClCH3 的产率增大。
(3)①0~5m i n内,用 CH2ClCHClCH3 表示的反应速率v(CH2ClCHClCH3)=0.016mol·L-1·m i n -1,平衡时生成 CH2ClCHClCH3的物质的量为0.8mol,则平衡时 HCl (g)的物质的量为1.2mol; 再用差量法计算出平衡时气体总物质的量为 3 mo l-0.8mo l= 2.2 mol,所以 HCl的 体 积 分 数 为![]() 54.5%。 ②由题中数据,利用三段式法可计算出平衡时,CH2=CHCH2Cl(g)、HCl(g)、CH2ClCHClCH3(g)的浓度分别为 0. 02 mo l· L-1、0.12mo l·L-1、
54.5%。 ②由题中数据,利用三段式法可计算出平衡时,CH2=CHCH2Cl(g)、HCl(g)、CH2ClCHClCH3(g)的浓度分别为 0. 02 mo l· L-1、0.12mo l·L-1、
0.08mo l·L-1,则 平 衡 常 数![]() ;
;
6m i n时的浓度商![]() ,平衡正向移动,所以v正 (HCl )>v逆 (HCl )。
,平衡正向移动,所以v正 (HCl )>v逆 (HCl )。
(4) ① 由 反 应 ii 和 图 甲 知, 一 定 温 度 下, 起 始 的![]() 越大,平衡时 Cl2 的体积分数越小。
越大,平衡时 Cl2 的体积分数越小。
②反应i i的正反应方向为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小。 ③由图乙知,温度为T1 时,正、逆反应的平衡常数相等,又因为二者互为倒数,则平衡常数 K=1。 w=1时,设 CH2 =CHCH3 和Cl2 的物质的量均为a mol,参加反应的 Cl2 的物质的量为b mol,利用三段式可列关系式: ![]() ,解得
,解得![]() 。
。
(5)该反应为反应前后气体分子总数相等的放热反应,反应向正反应方向进行,体系温度升高,气体膨胀,压强增大。

 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】某研究性学习小组同学为了探究“在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子”,他们以教材中相关【科学探究】为基础,设计了如下实验装置并记录相关实验数据。
【实验装置】

【部分实验数据】
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30 ℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30 ℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2的物质的量分别是________mol、________mol。
(2)该温度下,气体摩尔体积是__________。
(3)下列叙述不正确的是________。
A.气体摩尔体积与气体的温度相关
B.在该实验条件下,3 mol O2的气体摩尔体积为74.58 L·mol-1
C.同温、同压下,2 mol CO、CO2混合气体和2 mol O2的体积相同
D.该实验条件下,O2的密度为1.287 g·L-1
