题目内容
【题目】下列说法正确的是
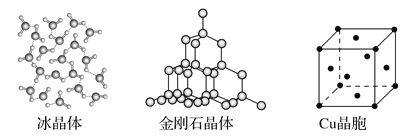
A. 石油裂解、煤的气化、海水制镁等过程中都包含化学变化
B. 可电解熔融MgCl2来制取金属镁,也能电解熔融AlCl3来制取铝
C. 铝热剂、盐酸、水玻璃、过氧化氢、明矾均为混合物
D. Na2O2、MgCl2、NaOH、NH4Cl均为含共价键的离子化合物
【答案】A
【解析】
B项AlCl3是共价化合物,熔融AlCl3不导电,金属铝通常用电解熔融氧化铝的方法制取,故错误;C项明矾是纯净物,故错误;D项氯化镁中不含共价键,故错误。

【题目】1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i. CH2=CHCH,3(g)+Cl2(g)![]() CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
ii. CH2=CHCH,3(g)+Cl2(g)![]() CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
已知:相关化学键的键能数据如下表所示:
化学键 | C—C | C—C | C—Cl | Cl—Cl |
E/( kJ mol-1) | 611 | x | 328 | 243 |
请回答下列问题:
(1)由反应i计算出表中x=_____________。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHC1CH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HC1,只发生反应CH2=CH CH2Cl (g)+HCl(g)![]() CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
①平衡时,HCl的体积分数为__________________(保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0. 6 mol CH2=CHCH2Cl、0.2molHC1和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)______________ (填“>”“<”或“=”)V逆(HCl).
(4)一定压强下,向密闭容器中充入一定量的CH2=CHCH3和C12发生反应ii。设起始的![]() =w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
=w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
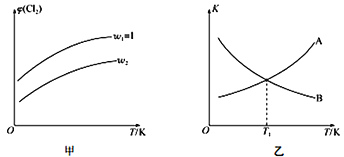
①图甲中,w2__________(填“>”“<”或“=”)1
②图乙中,表示正反应平衡常数的曲线为____________(填“A”或“B”),理由为________________。
③T1K下,平衡时a(Cl2)= ________________。
(5)起始时向某恒容绝热容器中充入1 mol CH2 =CHCH3和1 mol Cl2发生反应ii,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。