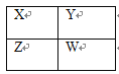
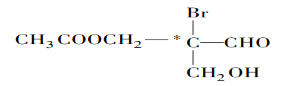题目内容
【题目】二氧化氮可由NO和O2生成,已知在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g) ΔH, n(NO)、n(O2)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)该反应的化学平衡常数表达式为K=___________________
(2)已知:K800 ℃>K1 000 ℃,则该反应的ΔH_________0(填“大于”或“小于”),
(3)用O2表示0~2 s内该反应的平均速率为_________。
(4)能说明该反应已达到平衡状态的是_________。
a.容器内气体颜色保持不变 b.2υ逆(NO)=υ正(O2)
c.容器内压强保持不变 d.容器内气体密度保持不变
(5)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有____。
A.升温 B.加入氧气 C. 降温 D.增大压强
(6)在800 ℃时,计算通入2 mol NO和1 mol O2的平衡常数K=_________
(7)已知下列反应在某温度下的平衡常数以及ΔH
H2(g)+S(s) H2S(g) K1 ΔH1
S(s)+O2(g) SO2(g) K2 ΔH2
则在该温度下反应H2(g)+SO2(g) O2(g)+H2S(g) K3 ΔH3
平衡常数K3=__________(用含有K1 K2的式子表示);
其反应热ΔH3=________(用含有ΔH1 ΔH2的式子表示)
【答案】 【解析】 (1)化学平衡常数等于生成物浓度幂次方乘积比上反应物浓度幂次方乘积,故答案为 (2) 由已知条件可知升高温度化学平衡常数减小,说明升高温度平衡逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应为放热反应,即△H<0。 (3)从0~2 s内用O 2表示该反应的平均速率为υ(O2)= (4)a、因为反应是在恒容的密闭容器中发生的,只有NO 2是红棕色,其它气体都是无色的,若容器内颜色保持不变,说明各种气体的物质的量不变,可证明反应达到平衡状态; b、达到平衡时正逆反应速率相等,即υ逆(NO)=2υ正(O2),2υ逆(NO)=υ正(O2)时反应没有达到平衡状态; c、反应是个反应前后气体体积不等的反应,所以当压强不变时可证明反应达到平衡状态; d、反应前后均为气体,容器体积不变,所以密度始终不变,容器内气体密度不变不能说明反应达到平衡状态; 故选ac; (5)A、升高温度,平衡向吸热反应方向移动,即逆向移动,故A不符合题意; B、加入氧气,反应物浓度升高,反应速率增大,平衡正向移动,一氧化氮转化率增大,故B符合题意; C、降低温度,反应速率减小,故C不符合题意; D、增大压强,反应速率增大,平衡正向移动,一氧化氮转化率增大,故D符合题意; 故选BD; (6)根据表中数据,平衡时NO、O2、NO2物质的量依次为0.05mol、0.025mol、0.15mol,物质的量浓度依次为0.025mol/L、0.0125mol/L、0.075mol/L,依据平衡常数表达式有 (7)H2(g)+SO2(g) O2(g)+H2S(g)由第一个方程式减去第二个方程式得到,由盖斯定律相关知识有:方程式相减,平衡常数相除,故K3=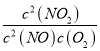 小于 0.015 molL-1s-1 a c BD 720
小于 0.015 molL-1s-1 a c BD 720 ![]()
![]() ΔH1-ΔH2
ΔH1-ΔH2 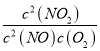 ;
;![]() mol/L÷2s=0.015mol/(L·s);
mol/L÷2s=0.015mol/(L·s);![]() ,温度均为800℃,平衡常数与加入的量无关,故答案为:720;
,温度均为800℃,平衡常数与加入的量无关,故答案为:720;![]() ,H3=ΔH1-ΔH2,答案为:
,H3=ΔH1-ΔH2,答案为:![]() ,ΔH1-ΔH2。
,ΔH1-ΔH2。
欢乐寒假福建教育出版社系列答案
智多星寒假生活新疆美术摄影出版社系列答案
寒假天地河北教育出版社系列答案
智乐文化中考备战系列答案
中考妙策33套汇编系列答案
文轩致胜中考系列答案
快乐假期高考状元假期学习方案寒假系列答案
创新学习寒假作业东北师范大学出版社系列答案
寒假零距离系列答案
高效中考安徽师范大学出版社系列答案