题目内容
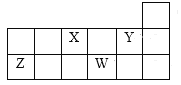
【题目】X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图,下列说法不正确的是( )
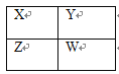
A.Y的气态氢化物的稳定性一定比W的强
B.W的原子序数可能是Y的原子序数的2倍
C.Y原子形成的简单离子半径一定比X原子形成的简单离子半径大
D.若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性
【答案】C
【解析】
A. 根据X、Y、Z、W四种短周期主族元素在周期表中的相对位置可知,Y、W处于同主族,Y的非金属性大于W,则Y的气态氢化物的稳定性一定比W的强,A正确;
B. 若W是S,其原子序数为16,则Y是O,其原子序数为8,B正确;
C.Y原子形成的简单离子半径(例如Cl-)比X原子形成的简单离子(S2-)半径小,C不正确;
D. 若Z元素最高价氧化物的水化物是强酸,只能是硫酸,则W元素的单质一定是氯气,具有强氧化性,D正确。
故选C。

【题目】二氧化氮可由NO和O2生成,已知在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g) ΔH, n(NO)、n(O2)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)该反应的化学平衡常数表达式为K=___________________
(2)已知:K800 ℃>K1 000 ℃,则该反应的ΔH_________0(填“大于”或“小于”),
(3)用O2表示0~2 s内该反应的平均速率为_________。
(4)能说明该反应已达到平衡状态的是_________。
a.容器内气体颜色保持不变 b.2υ逆(NO)=υ正(O2)
c.容器内压强保持不变 d.容器内气体密度保持不变
(5)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有____。
A.升温 B.加入氧气 C. 降温 D.增大压强
(6)在800 ℃时,计算通入2 mol NO和1 mol O2的平衡常数K=_________
(7)已知下列反应在某温度下的平衡常数以及ΔH
H2(g)+S(s) H2S(g) K1 ΔH1
S(s)+O2(g) SO2(g) K2 ΔH2
则在该温度下反应H2(g)+SO2(g) O2(g)+H2S(g) K3 ΔH3
平衡常数K3=__________(用含有K1 K2的式子表示);
其反应热ΔH3=________(用含有ΔH1 ΔH2的式子表示)
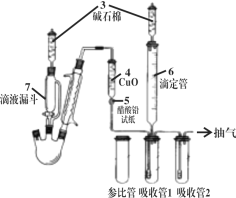
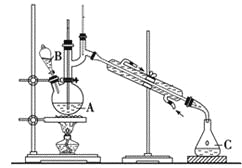
【题目】某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:
![]()
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是_____________________。
(2)加入沸石的作用是_________________。
(3)分液漏斗使用前必须进行的操作是__________________。
(4)反应温度应保持在90~95℃,其原因是___________________。
(5)本实验中,正丁醛的产率为___________________。