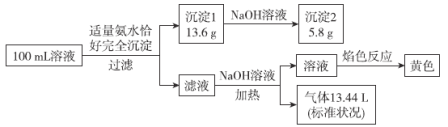
题目内容
【题目】利用如图所示装置不能完成对应实验的是( )
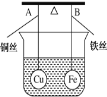
A.图甲可以用来制备Fe(OH)3胶体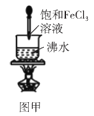
B.图乙可以用来证明酸性强弱顺序:H2SO4>H2CO3>H2SiO3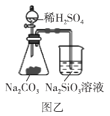
C.图丙可以通过点燃肥皂泡来检验是否有氢气气体生成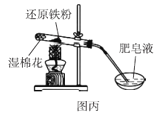
D.图丁可以用陶瓷坩埚加热融化NaOH固体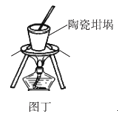
【答案】D
【解析】
A. 可通过将饱和氯化铁溶液滴加到沸水中制备Fe(OH)3胶体,A项正确;
B. 硫酸与碳酸钠反应得到二氧化碳和水,二氧化碳和水与硅酸钠反应得到硅酸,通过强酸制弱酸原理,可证明酸性强弱顺序:H2SO4>H2CO3>H2SiO3,B项正确;
C. 还原铁粉在加热下会与水蒸气反应得到氢气,通过点燃肥皂泡,听到爆鸣声,证明有氢气气体,C项正确;
D. 陶瓷坩埚成分有二氧化硅可氧化铝,都会与NaOH反应,不可以用陶瓷坩埚加热融化NaOH固体,D项错误;
答案选D。

【题目】二氧化氮可由NO和O2生成,已知在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g) ΔH, n(NO)、n(O2)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)该反应的化学平衡常数表达式为K=___________________
(2)已知:K800 ℃>K1 000 ℃,则该反应的ΔH_________0(填“大于”或“小于”),
(3)用O2表示0~2 s内该反应的平均速率为_________。
(4)能说明该反应已达到平衡状态的是_________。
a.容器内气体颜色保持不变 b.2υ逆(NO)=υ正(O2)
c.容器内压强保持不变 d.容器内气体密度保持不变
(5)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有____。
A.升温 B.加入氧气 C. 降温 D.增大压强
(6)在800 ℃时,计算通入2 mol NO和1 mol O2的平衡常数K=_________
(7)已知下列反应在某温度下的平衡常数以及ΔH
H2(g)+S(s) H2S(g) K1 ΔH1
S(s)+O2(g) SO2(g) K2 ΔH2
则在该温度下反应H2(g)+SO2(g) O2(g)+H2S(g) K3 ΔH3
平衡常数K3=__________(用含有K1 K2的式子表示);
其反应热ΔH3=________(用含有ΔH1 ΔH2的式子表示)
【题目】(1)下表是不同温度下水的离子积数据:
温度/℃ | 25 | T1 | T2 |
Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
①已知25℃< T1< T2 ,在T1时,水中 c(H+)______c(OH-), 则a_____1×10-14(填“<”、“>”或“=”)。
②在T2下,将pH=1的H2SO4溶液V1 L与pH=11的NaOH溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 =_________。
(2)常温下,将0.01 mol/L的CH3COOH溶液体积Va与0.01 mol/L的NaOH溶液体积Vb混合,已知:CH3COOH稀溶液的电离平衡常数为Ka=2×10-5。
a. Va=Vb时,等体积混合后测得溶液为碱性,原因是:_____(用离子方程式解释),该平衡的平衡常数Kh=_________。
b.混合后溶液的pH=7,则Va ____Vb(填“<”、“>”或“=”);该混合溶液中离子浓度由大到小的排列:______。
c.常温条件下,pH=11的CH3COONa溶液,由水电离出的c(OH-)=___________。