题目内容
16.25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )| A. | 均存在电离平衡和水解平衡 | |
| B. | 分别加入NaOH固体,恢复至原温,c(CO32-)均增大 | |
| C. | c(OH-)前者大于后者 | |
| D. | 存在的粒子种类相同 |
分析 A、任何溶液中均存在水的电离平衡,在水溶液中碳酸氢根存在电离平衡和水解平衡;
B、分别加入NaOH固体,恢复到原温度,碳酸氢根和氢氧根在溶液反应会生成碳酸根和水,氢氧根对它们的水解均起到抑制作用;
C、碳酸根的水解程度大于碳酸氢根,水解规律:谁强显谁性;
D、碳酸氢根和氢氧根在溶液中不共存.
解答 解:A、Na2CO3溶液中存在水的电离平衡和碳酸根的水解平衡,NaHCO3在水溶液中存在碳酸氢根的电离平衡和水解平衡以及水的电离平衡,故A正确;
B、分别加入NaOH固体,恢复到原温度,碳酸氢根和氢氧根在溶液反应会生成碳酸根和水,氢氧根对它们的水解均起到抑制作用,所以c(CO32-)均增大,故B正确;
C、碳酸根的水解程度大于碳酸氢根,二者水解均显碱性,跟据水解规律:谁强显谁性,所以碳酸钠中的氢氧根浓度大于碳酸氢钠溶液中的氢氧根浓度,故C错误;
D、NaHCO3和Na2CO3溶液中存在的微粒均为:钠离子、碳酸根、碳酸氢根、氢氧根、氢离子、碳酸分子、水分子,存在的粒子种类相同,故D正确;
故选:C.
点评 本题考查学生盐的水解的应用,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
6.下列离子方程式的书写正确的是( )
| A. | 向稀NH4HCO3 溶液中滴加过量NaOH溶液:NH4++OH-═NH3•H2O | |
| B. | Ca(ClO)2 溶液中通入过量的SO2:C1O-+SO2+H2O═HClO+HSO3- | |
| C. | 向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2+4Fe2++6H2O═4Fe(OH)3↓+8Na++O2↑ | |
| D. | SO2使紫色石蕊溶液变红色:SO2+H2O═2H++SO32- |
4.下列有关环境、健康、发展的叙述中,不正确的是( )
| A. | 可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大 | |
| B. | 开发利用绿色能源(例如太阳能)替代化石燃料是人类可持续发展的必由之路 | |
| C. | 装修材料中的苯主要来自胶、漆等,是强致癌物 | |
| D. | 氟氯烃含量是空气质量报告的主要项目之一 |
11.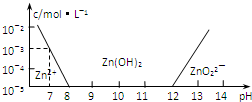 已知锌及其化合物的性质与铝及其化合物相似.现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的pH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或ZnO22-的物质的量浓度;假设Zn2+的浓度为10-5mol/L时,Zn2+已沉淀完全).则下列说法正确的是( )
已知锌及其化合物的性质与铝及其化合物相似.现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的pH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或ZnO22-的物质的量浓度;假设Zn2+的浓度为10-5mol/L时,Zn2+已沉淀完全).则下列说法正确的是( )
 已知锌及其化合物的性质与铝及其化合物相似.现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的pH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或ZnO22-的物质的量浓度;假设Zn2+的浓度为10-5mol/L时,Zn2+已沉淀完全).则下列说法正确的是( )
已知锌及其化合物的性质与铝及其化合物相似.现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的pH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或ZnO22-的物质的量浓度;假设Zn2+的浓度为10-5mol/L时,Zn2+已沉淀完全).则下列说法正确的是( )| A. | pH≥12时,发生反应的离子方程式为Zn2++4OH-═ZnO22-+2H2O | |
| B. | 若要使ZnCl2溶液中Zn2+沉淀完全,加入的NaOH溶液越多越好 | |
| C. | 向1L0.1mol/LZnCl2溶液中逐渐滴加NaOH溶液至pH=7,需NaOH 0.2mol | |
| D. | 若溶液的温度保持不变,则该温度下Zn(OH)2的溶度积Ksp=10-17 |
1.下列说法中错误的是( )
| A. | 煤中含有苯及苯的同系物,可以通过干馏得到 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 含C18以上的烷烃经过催化裂化可以得到汽油 | |
| D. | 石油含有C5~C11的烷烃,可通过分馏得到汽油 |
8.心酮胺是治疗冠心病的药物,它具有如下图所示的结构简式.则下列关于心酮胺的叙述不正确的是( )

| A. | 可以发生加成反应 | B. | 在催化剂作用下可以和溴反应 | ||
| C. | 可以发生银镜反应 | D. | 在一定条件下可以发生酯化反应 |
6.化学实验有助于理解化学知识,形成化学观念.下列实验操作正确的是( )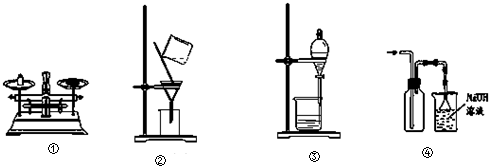

| A. | ①称量药品 | B. | ②过滤 | C. | ③分离乙醇和水 | D. | ④收集氯气 |

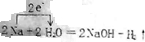 (直接标在答题卡的相应方程式上).
(直接标在答题卡的相应方程式上).