题目内容
7.上海世博会成为第一个“低碳世博”.主办方确定以“低碳、和谐、可持续发展的城市”为主题,将大量新能源、节能环保科技成果转化应用于世博会.
(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是C.(填字母序号)
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O$\frac{\underline{\;高温\;}}{\;}$2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O?CO+3H2
(2)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一.
2CO2(g)+6H2(g)-→CH3OCH3(g)+3H2O△H>0.
请在图1中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注.
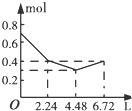
(3)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,
测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从3min到10min,v(H2)=0.11mol/(L•min).
②下列措施中能使$\frac{n(C{O}_{2}OH)}{nC{O}_{2}}$增大的是CD(选填编号).
A.升高温度B.恒温恒容再充入1mol CO2
C.将H2O(g)从体系中分离D.恒温恒容再充入1molCO2和3mol H2
E.将CH3OH(g)从体系中分离F.使用高效催化剂.
分析 (1)用水分解或电解都要消耗能源,天然气也是有限资源,只有太阳能是取之不尽用之不竭的能源;
(2)注意催化剂可降低反应所需的活化能;
(3)①根据图象计算v(CO2),根据反应速率之比等于化学计量数之比计算;
②使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量.
解答 解:(1)用水分解或电解都要消耗能源,天然气也是有限资源,只有太阳能是取之不尽用之不竭的能源,
A、消耗电能,不是最节能的方法,故A错误;
B、消耗热能,不是减碳的手段,故B错误;
C、利用太阳光催化分解水制氢是最节能的,故C正确;
D、天然气是非再生能源,且不是最节能的方法,故D错误;
故答案为:C;
(2)该反应△H>0,为吸热反应,所以生成物能量高于反应物,使用催化剂可降低反应的活化能,故可画出图为: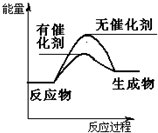 ,
,
故答案为: ;
;
(3)①由图象可知:v(CO2)=$\frac{0.25mol/L}{7min}$,则v(H2)=3v(CO2)=3×$\frac{0.25mol/L}{7min}$=0.11mol/(L•min),故答案为:0.11;
②使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量,
A、该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误;
B、恒温恒容再充入1mol CO2,虽然平衡正向移动,但是根据勒夏特列原理改变外界条件,平衡移动只能减弱这种改变,不能消除,所以n(CH3OH)/n(CO2)变小,故B错误;
C、将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确;
D、再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
E.将CH3OH(g)从体系中分离出来,减小了CH3OH(g)的浓度,虽然平衡正向移动,但是根据勒夏特列原理改变外界条件,平衡移动只能减弱这种改变,不能消除,所以n(CH3OH)/n(CO2)变小,故E错误;
F.使用高效催化剂,平衡不移动,所以n(CH3OH)/n(CO2)不变,故F错误;
故答案为:CD.
点评 本题主要考查了绿色化学、化学反应中的能量变化、影响化学平衡移动的条件等知识点,中等难度,注重对基本原理的理解.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 4L 0.5mol•L-1NaCl溶液 | B. | 1L 0.3mol•L-1Na2SO4溶液 | ||
| C. | 2L 0.15mol•L-1Na2CO3溶液 | D. | 0.8L 0.4mol•L-1NaOH溶液 |
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2-氯甲苯 |
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 原子晶体中的相邻原子间可能存在极性共价键 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 金属晶体的熔点和沸点都很高 |
| A. | 淀粉 | B. | 蚕丝 | C. | 豆油 | D. | 聚丙烯酸甲酯 |
| A. | 均存在电离平衡和水解平衡 | |
| B. | 分别加入NaOH固体,恢复至原温,c(CO32-)均增大 | |
| C. | c(OH-)前者大于后者 | |
| D. | 存在的粒子种类相同 |
| A. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| B. | 1 L 1 mol•L-1 NH4NO3溶液中氮原子数小于2NA | |
| C. | 常温常压下,11.2 g乙烯中含有共用电子对数目为2.4NA | |
| D. | 标准状况下,22.4 L CHCl3中所含有的分子数为NA |