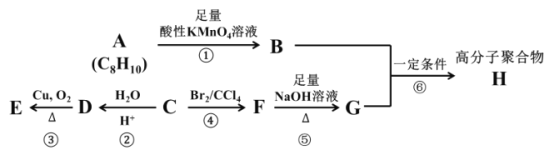
题目内容
【题目】反应aA(g)+bB(g)cC(g) ΔH<0在等容条件下进行。改变其它反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示,下列说法不正确的是
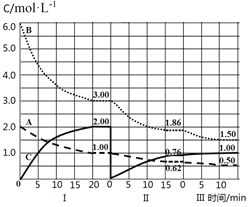
A.反应的化学方程式中,a:b:c=1:3:2
B.第II阶段反应温度小于第III阶段反应温度
C.A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A),最大的是vⅠ(A)
D.由第一次平衡到第二次平衡,采取的措施是从反应体系中移走C
【答案】B
【解析】
A.根据图象知,随着反应的进行,A和B的浓度减小,C的浓度增大,则A和B是反应物,C是生成物,A、B、C的化学计量数之比=(2.0﹣1.00)mol/L:(6.0﹣3.00)mol/L:(2.00﹣0)mol/L=1:3:2,所以该反应方程式为:A(g)+3B(g)![]() 2C(g),A正确;
2C(g),A正确;
B.第Ⅲ阶段开始时与第Ⅱ阶段各物质的量相等,A、B的量减少,C的量增加,可判断平衡正向移动,且不可能是浓度变化所致,应为温度的影响,因A、B的浓度减小,平衡右移,所以应为降低温度,B错误;
C.A在Ⅰ阶段反应速率为0.05mol/(Lmin),Ⅱ为0.025mol/(Lmin),Ⅲ为0.012mol/(Lmin),所以速率最大的是vⅠ(A),C正确;
D.图象信息显示,第一次平衡后改变条件,C的浓度为0,然后随反应正向移动C浓度逐渐增大,A和B浓度减小,说明平衡正向进行,改变的条件是移走C,D正确;
故选B。

【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和②B. ②和④C. ③和④D. ①和③