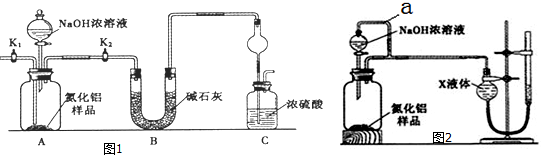
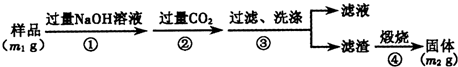
题目内容
18.已知氧化性Br2>Fe3+.向含溶质a mol的FeBr2溶液中通入b mol Cl2,充分反应.下列说法不正确的是( )| A. | 离子的还原性强弱:Fe2+>Br->Cl- | |
| B. | 当a≥2b时,发生的离子反应:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 当a=b时,反应后的离子浓度:c(Fe3+):c(Br-):c(Cl-)=1:2:2 | |
| D. | 当3a≤2b时,发生的离子反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
分析 还原性Fe2+>Br-,首先发生反应:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,再发生反应:2Br-+Cl2=2Cl-+Br2,a mol的FeBr2溶液中含有amolFe2+、2amolBr-,
A.氧化性越强,相应离子的还原性越弱;
B.amolFe2+消耗0.5amolCl2,当a≥2b时,只有Fe2+被氯气氧化;
C.当a=b时,由2Fe2++Cl2=2Fe3++2Cl-可知,amolFe2+消耗0.5amolCl2,生成amolFe3+、amolCl-,由2Br-+Cl2=2Cl-+Br2可知,0.5amolCl2,消耗amolBr-,又生成amolCl-,溶液中剩余Br-为amol;
D.amolFe2+消耗0.5amolCl2,2amolBr-消耗amolCl2,当3a≤2b时,Fe2+、Br-完全被氧化.
解答 解:还原性Fe2+>Br-,首先发生反应:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,再发生反应:2Br-+Cl2=2Cl-+Br2,a mol的FeBr2溶液中含有amolFe2+、2amolBr-,
A.氧化性越强,相应离子的还原性越弱,故离子的还原性强弱:Fe2+>Br->Cl-,故A正确;
B.amolFe2+消耗0.5amolCl2,当a≥2b时,只有Fe2+被氯气氧化,反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故B正确;
C.当a=b时,由2Fe2++Cl2=2Fe3++2Cl-可知,amolFe2+消耗0.5amolCl2,生成amolFe3+、amolCl-,由2Br-+Cl2=2Cl-+Br2可知,0.5amolCl2,消耗amolBr-,又生成amolCl-,溶液中剩余Br-为amol,反应后的离子浓度:c(Fe3+):c(Br-):c(Cl-)=a:a:2a=1:1:2,故C错误;
D.amolFe2+消耗0.5amolCl2,2amolBr-消耗amolCl2,当3a≤2b时,Fe2+、Br-完全被氧化,发生的离子反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-故D正确,
故选:C.
点评 本题考查氧化还原反应计算、离子方程式书写等,关键是明确离子发生反应的先后顺序,难度中等.

| A. | 一定温度和压强下,气体体积的大小,由构成气体的分子大小决定 | |
| B. | 一定温度和压强下,气体体积的大小,由构成气体的分子数决定 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 气体摩尔体积指1mol任何气体所占的体积约为22.4L |
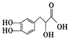 ,下列有关丹参素的说法错误的是( )
,下列有关丹参素的说法错误的是( )| A. | 能燃烧且完全燃烧生成CO2和H2O | B. | 不能发生加成反应 | ||
| C. | 可以发生酯化反应 | D. | 能与NaHCO3、Na反应 |
| A. | 核素${\;}_{1}^{2}$H的中子数是0 | |
| B. | 12C和14C互为同位素 | |
| C. | 金刚石、石墨和富勒烯互为同素异形体 | |
| D. | CH3CH2OH和CH3OCH3互为同分异构体 |
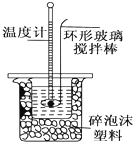 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液.若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体0.50mol•L-1×0.25L×40g•mol-1=5.0 g.(请列式计算出结果,无列式,结果不给分)
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):_$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1_.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数据结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)a、b、c、d.
a.实验装置保温、隔热效果差
b.配制NaOH溶液定容时仰视刻度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
| A. | 澄清透明的水溶液中:K+、Ba2+、OH-、MnO4- | |
| B. | pH=13的溶液中:Cl-,HCO3-,NO3-,NH4+ | |
| C. | c(Fe3+)=0.1mol•L-1的溶液中:Na+、SCN-、Cl-、Br- | |
| D. | 强碱性溶液中:ClO-、SO42-、SO32-、Na+ |