题目内容
20.下列实验操作、现象和结论均正确的是( )| 选项 | 实验操作 | 现象 | 结论 |
| A | 将干燥纯净的氯气通入装有湿润的红色纸条的试剂瓶中 | 红色褪去 | 氯气有漂白性 |
| B | 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中 | 酸性KMnO4溶液紫红色褪去 | 证明乙烯能被酸性高锰酸钾氧化 |
| C | 取少量BaSO4固体于试管中,加入足量的盐酸 | 沉淀不溶解 | BaSO4不溶于盐酸,且可以用盐酸和BaCl2溶液检验SO42- |
| D | 在分液漏斗中加入碘水后再加入苯,充分振荡 | 分层,且上层溶液呈紫色 | 苯可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.次氯酸有漂白性;
B.乙醇可与酸性高锰酸钾发生氧化还原反应;
C.SO42-可以用盐酸和BaCl2溶液检验;
D.苯的密度比水小.
解答 解:A.氯气与水反应生成次氯酸,次氯酸有漂白性,氯气无漂白性,故A错误;
B.乙醇可与酸性高锰酸钾发生氧化还原反应,应先除去乙醇,故B错误;
C.加入足量盐酸,没有沉淀生成,说明不是银离子,没有气体产生,说明不是碳酸根离子、亚硫酸根离子,再滴加氯化钡,产生白色沉淀,则溶液中一定含有硫酸根离子,故C正确;
D.苯的密度比水小,上层呈紫色,故D正确;
故选CD.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、氧化还原反应、离子的检验及物质的分离提纯等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
11.下表中的实验操作能达到实验目的或能得出相应结论的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在硅酸钠溶液中滴入稀盐酸,溶液变浑浊. | 非金属性:Cl>Si |
| B | C2H5Br与Br2的溶液混合中加入Na2SO3溶液充分振荡后分液 | 除去C2H5Br中的溴 |
| C | 向某溶液中加氯化钡溶液产生白色沉淀,再加稀硝酸沉淀不消失 | 说明原溶液中一定含有 SO42- |
| D | 向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去 | 证明生成的气体全部是 乙烯 |
| A. | A | B. | B | C. | C | D. | D |
8.(双项)常温下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3•H2O)=1×10-4mol•L-1 | |
| B. | 由CH3COOH与CH3COONa组成的pH=5.6的混合溶液中:c(Na+)<c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①<② |
15.向BaCl2溶液中通入物质的量之比为1:2的某混合气体,无沉淀产生,则该混合气体是( )
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO和SO2 | D. | NO2和SO2 |
12.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molCl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1LpH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21g乙烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol${\;}_{6}^{14}$C原子中所含中子数目为6NA |

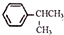 可写成
可写成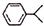
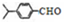 ,上述合成路线中①属于加成反应;
,上述合成路线中①属于加成反应;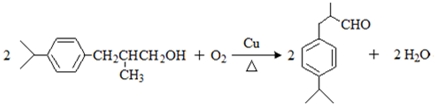 .
.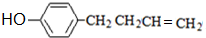 .
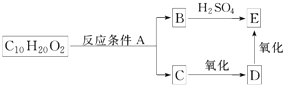
.
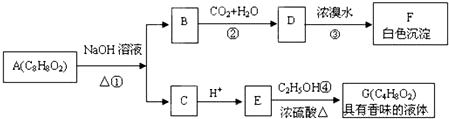
 .
.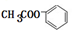 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$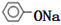 +CH3COONa+H2O.
+CH3COONa+H2O.
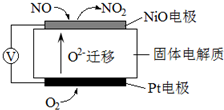
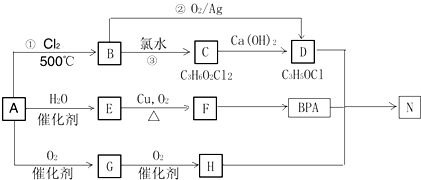
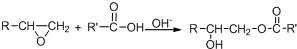
 .
.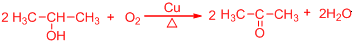 .
.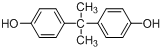 所示,下列说法正确的是ab.
所示,下列说法正确的是ab. .
.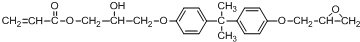
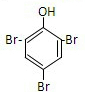
 (其中两种).
(其中两种).