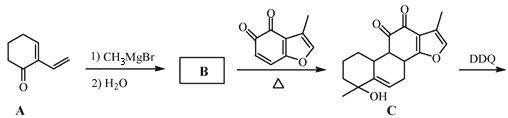
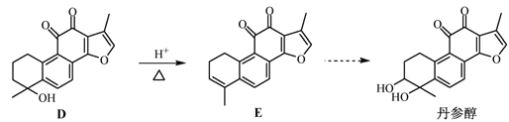
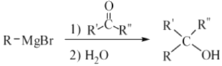
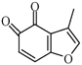
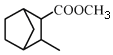
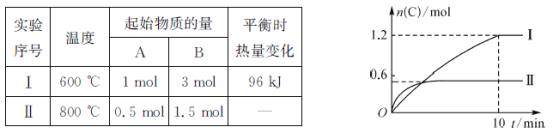
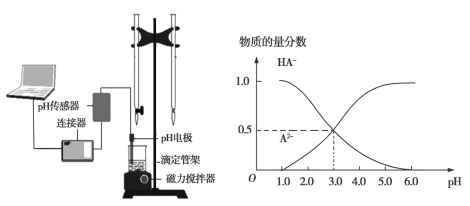
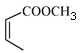题目内容
【题目】H2NNO2(硝酰胺,Nitrarnide)是一种弱酸,常温下Ka1=10-5.6。常温下,硝酰胺分解反应,H2NNO2(aq)=N2O(g)+H2O(l)的第-步为O2NNH2(aq)![]() O2NNH-(aq)+H+(aq),其中k为速率常数,υ正=k1c(O2NNH2),υ逆=k-1c(O2NNH-)·c(H+),则
O2NNH-(aq)+H+(aq),其中k为速率常数,υ正=k1c(O2NNH2),υ逆=k-1c(O2NNH-)·c(H+),则![]() 等于( )
等于( )
A.5.6B.8.4C.-5.6D.-8.4
【答案】C
【解析】
Ka1= ,当反应达到平衡状态时,υ正=υ逆,据此进行计算。
,当反应达到平衡状态时,υ正=υ逆,据此进行计算。
Ka1= =10-5.6,当反应达到平衡状态时,υ正=υ逆,即k1c(O2NNH2)= k-1c(O2NNH-)·c(H+),那么
=10-5.6,当反应达到平衡状态时,υ正=υ逆,即k1c(O2NNH2)= k-1c(O2NNH-)·c(H+),那么![]() =
= =10-5.6,因此
=10-5.6,因此![]() =lg(10-5.6)=-5.6;
=lg(10-5.6)=-5.6;
答案选C。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】![]() 俗称海波
俗称海波![]() 是常用的一种定影剂。工业使用的海波中常混有少量
是常用的一种定影剂。工业使用的海波中常混有少量![]() 和
和![]() 的杂质,为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的稀硫酸20mL,充分反应后测得有关实验数据如下
的杂质,为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的稀硫酸20mL,充分反应后测得有关实验数据如下![]() 标准状况
标准状况![]() 。
。
第一份 | 第二份 | 第三份 | |
样品的质量 |
|
|
|
二氧化硫的体积 |
|
|
|
硫的质量 |
|
|
|
下列说法错误的是 ![]()
![]()
A.第一份、第二份样品均完全反应,第三份样品过量
B.样品中![]() :
:![]() :1
:1
C.样品中除了含有![]() 、
、![]() ,还含有
,还含有![]()
D.所加硫酸溶液的物质的量浓度为![]()
【题目】HClO4、H2SO4、HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋酸中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4![]() 2H++
2H++![]()
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
【题目】已知![]() 时,几种难溶电解质的溶度积常数
时,几种难溶电解质的溶度积常数![]() 如表所示:
如表所示:
难溶电解质 | AgCl | AgBr | AgI |
|
|
Ksp |
|
|
|
|
|
下列叙述正确的是
A.溶度积常数越小该物质的溶解性一定越小
B.将浓度均为![]()
![]() 的
的![]() 溶液和
溶液和![]() 溶液等体积混合,有
溶液等体积混合,有![]() 沉淀生成
沉淀生成
C.向AgCl的悬浊液中滴加饱和NaI溶液不能得到黄色AgI
D.向100![]()
![]() 的
的![]() 溶液中加入等体积等物质的量浓度的
溶液中加入等体积等物质的量浓度的![]() 溶液,有白色沉淀生成
溶液,有白色沉淀生成