题目内容
【题目】(加试题)氯化亚铜常用作有机合成工业中的催化剂,为白色晶体,不溶于乙醇,微溶于水,易溶于浓盐酸形成络合离子([CuCl2]-)。受潮露置空气中迅速氧化成碱式盐。实验室用下列流程制备:
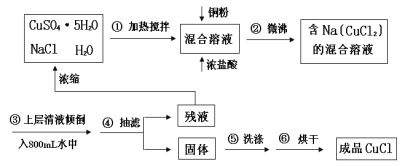
已知:Na[CuCl2](易电离,溶液无色) ![]() NaCl+CuCl↓(白色沉淀)。
NaCl+CuCl↓(白色沉淀)。
请回答以下问题:
(1)写出实验室制取Na[CuCl2]的离子方程式__________
(2)判断步骤②反应完全的现象是____________
(3)步骤③的目的是__________________________________。
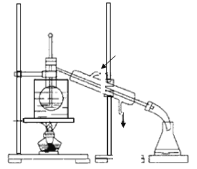
(4)步骤④有关抽滤操作,下列说法正确的是_______
A. 选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B. 在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C. 抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D. 洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(5)定量 称取1.850g CuCl样品(杂质不参与反应),溶于一定量的0.5000mol·L-1FeCl3溶液中,加水稀释至200mL得到溶液,取20.00mL 用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗18.00mLCe(SO4)2 。
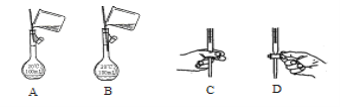
①此实验涉及溶液配制与定量滴定的基本操作中,其中合理的是___________;
②有关反应式:Fe3++CuCl=Fe2++Cu2++Cl- Ce4++Fe2+=Fe3++Ce3+则样品中CuCl的质量分数____________。
【答案】Cu2+ + 4Cl- + Cu = 2[Cu Cl2]- 反应溶液由蓝色转变成无色透明时为止 使Na[CuCl2]转化为CuCl AD BC 96.81%
【解析】
(1)硫酸铜、浓盐酸和铜反应生成Na[CuCl2]。
(2)铜离子为蓝色,Na[CuCl2]为无色,如果步骤②反应完全,则溶液中不存在铜离子的颜色。
(3)步骤③的目的是使Na[CuCl2]转化为CuCl。
(4)A.颗粒太小的沉淀易在滤纸上形成一层密实的沉淀,溶液不易透过,则选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀。
B.在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的短导管相接,否则易使水进入安全瓶。
C.胶状沉淀易透过滤纸而不易采用抽滤方法。
D.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失。
(5)①溶液配制时,向容量瓶中转移溶液时,溶液不能沾到容量瓶刻度线上面,在打开酸式滴定管活塞时,要把活塞放在手心的位置,手指从另一侧打开活塞。
②Fe3++CuCl=Fe2++Cu2++Cl- ,Ce4++Fe2+=Fe3++Ce3+可得到Ce4+~Fe2+~CuCl。
(1)硫酸铜、浓盐酸和铜反应生成Na[CuCl2],离子方程式为:Cu2+ + 4Cl- + Cu = 2[Cu Cl2]- ,故答案为:Cu2+ + 4Cl- + Cu = 2[Cu Cl2]-。
(2)铜离子为蓝色,Na[CuCl2]为无色,如果步骤②反应完全,则溶液中不存在铜离子的颜色,所以判断反应完全的现象是反应溶液由蓝色转变成无色透明时为止,故答案为:反应溶液由蓝色转变成无色透明时为止。
(3)步骤③的目的是使Na[CuCl2]转化为CuCl,故答案为:使Na[CuCl2]转化为CuCl。
(4)A.颗粒太小的沉淀易在滤纸上形成一层密实的沉淀,溶液不易透过,则选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀,故A正确;
B.在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的短导管相接,否则易使水进入安全瓶,故B错误;
C.胶状沉淀易透过滤纸而不易采用抽滤方法,故C错误;
D.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失,故D正确。
故选AD。
(5)①溶液配制时,向容量瓶中转移溶液时,溶液不能沾到容量瓶刻度线上面,在打开酸式滴定管活塞时,要把活塞放在手心的位置,手指从另一侧打开活塞,故选BC。
②Fe3++CuCl=Fe2++Cu2++Cl- ,Ce4++Fe2+=Fe3++Ce3+可得到Ce4+~Fe2+~CuCl,n(Ce4+)=0.1000molL-1×0.018L=0.0018mol,则1.850g样品中含有n(CuCl)=10×0.0018mol=0.018mol,质量m(CuCl)=0.018mol×99.5g/mol=1.791g,因此样品中CuCl的质量分数=(1.791g/1.850g)×100%≈96.81%,故答案为:96.81%。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】现有四瓶失去标签的无色溶液,可能是CaCl2、AgNO3、HCl、Na2CO3中的其中一种,为了确定具体成分,随意将四瓶溶液标记为A、B、C、D后,进行了下列四组实验。
实验顺序 | 实验内容 | 实验现象 |
① | A+B | 无明显现象 |
② | B+D | 有气体放出 |
③ | B+C | 有沉淀生成 |
④ | A+D | 有沉淀生成 |
根据表中实验现象回答下列问题:
(1)A、B、C、D分别对应的溶质化学式为____________、___________、___________、___________;
(2)请分别写出上述实验②和③的离子方程式:
②________________________________________________________;
③________________________________________________________。