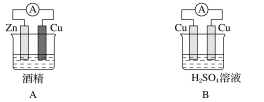
题目内容
【题目】短周期元素 A、B、C、D、E、F 六种元素,它们的原子序数由 A 到 F依次增大。在周期表中,A 的原子半径最小。B 元素的原子最外层电子数是内层电 子数的两倍,C 为地壳中含量最多的元素,D 是原子半径最大的短周期主族元素,D 单质燃烧时呈现黄色火焰,D 的单质在高温下与 C 的单质充分反应,可以得到与 E 单质颜色相同的淡黄色固态化合物。D 与 F 形成的化合物 DF 是常用的调味品。试根 据以上叙述回答:
(1)元素符号:A____________、B____________、C____________、D____________。
(2)E 在元素周期表中的位置:_____________________。
(3)F 离子结构示意图:______________________。
(4)A、B 组成的最简单化合物的名称是_____。
(5)C 、D 按原子个数比 1∶1 组成的一种化合物与水发生反应的化学方程式为_____________________。
(6) 能说明 E 的非金属性比 F 的非金属性_____( 填“强”或“弱”) 的事实是____(举一例)。
【答案】H C O Na 第三周期第ⅥA族 ![]() 甲烷 2Na2O2+2H2O===4NaOH+O2↑ 弱 氯气能从硫化钠溶液中置换出硫(答案合理即可)
甲烷 2Na2O2+2H2O===4NaOH+O2↑ 弱 氯气能从硫化钠溶液中置换出硫(答案合理即可)
【解析】
A、B、C、D、E、F 为原子序数依次增大短周期元素。A的原子半径最小,则A为H元素,C为地壳中含量最多的元素,则C为O元素,B元素的原子最外层电子数是内层电子数的两倍,则B为第二周期元素,原子结构为 ,B为C元素,D是原子半径最大的短周期主族元素,则D为Na,Na在O2中燃烧生成Na2O2为淡黄色,E单质为淡黄色的固体,则E为S元素,D与F形成的离子化合物DF是常用的调味品,则DF为NaCl,F为Cl元素,据此分析解答。
,B为C元素,D是原子半径最大的短周期主族元素,则D为Na,Na在O2中燃烧生成Na2O2为淡黄色,E单质为淡黄色的固体,则E为S元素,D与F形成的离子化合物DF是常用的调味品,则DF为NaCl,F为Cl元素,据此分析解答。
(1)根据上述分析可知,A为H,B为C,C为O,D为Na,E为S,F为Cl,故答案为:H;C;O;Na;
(2)E为S元素,为16号元素,在周期表中的位置为第三周期第VIA族,故答案为:第三周期第ⅥA族;
(3)F离子为Cl-,其离子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(4)A、B组成的最简单的化合物为CH4,名称是甲烷,故答案为:甲烷;
(5)C、D按原子个数比1:1组成的化合物为Na2O2,其和水反应生成氢氧化钠和氧气,化学反应方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(6)E为S,F为Cl,氯气能从硫化钠溶液中置换出硫,非金属性越强的元素,其单质的氧化性越强,则S的非金属性比Cl弱,故答案为:弱;氯气能从硫化钠溶液中置换出硫(答案合理即可)。

【题目】氮族元素单质及其化合物有着广泛应用。
![]() 在
在![]() 密闭容器中放入
密闭容器中放入![]()
![]() ,一定温度进行如下反应
,一定温度进行如下反应![]()
反应时间![]() 与容器内气体总压强
与容器内气体总压强![]() 的数据见下表:
的数据见下表:
时间 温度 | 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| -- | -- | -- |
|
|
回答下列问题:
![]() 的电子式为______。
的电子式为______。
![]() 温度下,反应平衡常数
温度下,反应平衡常数![]() ______。
______。
![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,
,![]() 的平衡转化率
的平衡转化率![]() ______
______![]() 。
。
![]() 在一定条件下发生如下分解:
在一定条件下发生如下分解:![]() 在温度和容积不变的条件下,能说明该反应已达到平衡状态的是______
在温度和容积不变的条件下,能说明该反应已达到平衡状态的是______![]() 填字母序号
填字母序号。
a.n(N2O)=n(NO2) b.容器内压强保持不变 c.υ正(N2O)=υ正(NO2) d.气体颜色保持不变