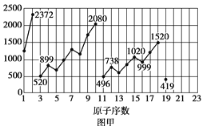
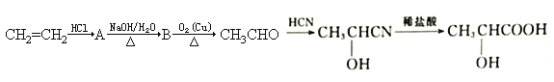
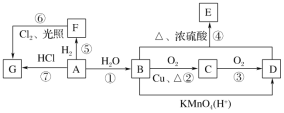
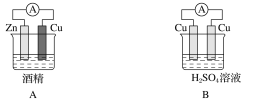
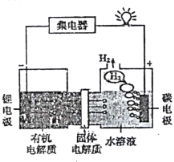
题目内容
【题目】硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③ ,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是____。
(2)写出实验步骤②中的化学方程式____。
(3)补全实验步骤③的操作名称____。
(4)实验步骤④中用少量冰水洗涤晶体,其目的是___。
(5)乙同学认为甲的实验方案中存在明显的不合理之处,你___(填“是”或“否”)同意乙的观点。
(6)丙同学经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
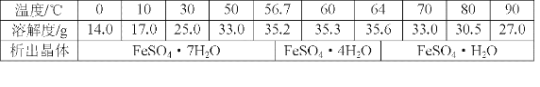
若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为___。
(7)取已有部分氧化的绿矾固体(硫酸亚铁的相对原子质量用M表示)wg,配制成100mL用cmol/L KMnO4标准溶液滴定,终点时消耗标准液的体积为VmL,则:若在滴定终点读取滴定管读数时,俯视滴定管液面,使测定结果___(填“偏高”、“偏低”或“无影响”)
【答案】去除油污或利用碳酸钠水解后显碱性的性质除去表面油污 Fe+H2SO4(稀)![]() FeSO4+H2↑ 趁热过滤 洗去杂质,降低洗涤过程中FeSO4·7H2O的损耗 是 56.7℃<t<64℃ 偏低
FeSO4+H2↑ 趁热过滤 洗去杂质,降低洗涤过程中FeSO4·7H2O的损耗 是 56.7℃<t<64℃ 偏低
【解析】
(1)Na2CO3溶液显碱性,油脂在碱溶液中水解生成溶于水的物质;
(2)实验步骤②中的化学反应是一定温度下铁和稀硫酸反应生成硫酸亚铁和氢气;
(3)步骤③是趁热过滤避免硫酸亚铁损耗;
(4)步骤④中用少量冰水洗涤晶体是洗涤表面杂质,温度降低硫酸亚铁溶解度减小;
(5)铁屑耗尽,不能防止亚铁离子被氧化;
(6)依据图表数据分析,析出晶体FeSO44H2O的温度范围;
(7)若在滴定终点读取滴定管刻度时,俯视标准液液面,读取标准溶液体积减小。
(1)Na2CO3溶液中碳酸根离子水解显碱性,铁屑表面含有油脂,油脂在碱性条件下,水解成可溶水的物质,步骤①的目的是除去铁屑表面的油污,故答案为:去除油污或利用碳酸钠水解后显碱性的性质除去表面油污;
(2)发生化学方程式为Fe+H2SO4![]() FeSO4+H2↑;
FeSO4+H2↑;
(3)步骤③将滤液转入到密闭容器,冷却结晶,因此步骤③的操作名称为趁热过滤,故答案为:趁热过滤;
(4)一般温度低,晶体的溶解度低,冰水洗涤的目的是洗去表面的杂质,减少FeSO4·7H2O的损耗,故答案为:洗去杂质,降低洗涤过程中FeSO4·7H2O的损耗;
(5)步骤②中铁屑耗尽,铁转化成Fe2+,Fe2+容易被氧化成Fe3+,即同意乙同学的观点,故答案为:是;
(6)根据表格中的数据,得到FeSO4·4H2O,在56.7℃、64℃同时析出两种晶体,因此温度控制在高于56.7℃,低于64℃,范围是56.7℃<t<64℃;
(7)根据滴定管从上到下刻度增大,俯视读数,V偏小,消耗标准液体积减少,因此所测结果偏低。

【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据见下表:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g.cm3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性________(填“大于”、“等于”或“小于”)相应的醇,其原因是______________________________________________________________。
(3)将1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___________________,但在制备1溴丁烷时却不能边反应边蒸出产物,其原因是___________________________。