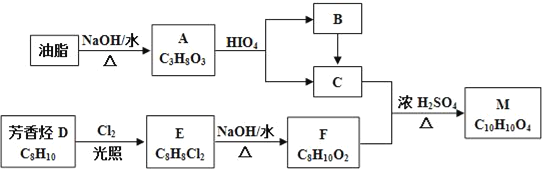
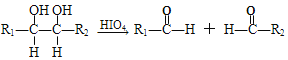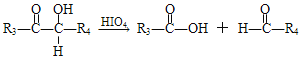题目内容
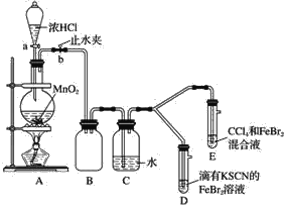
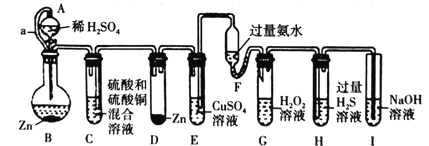
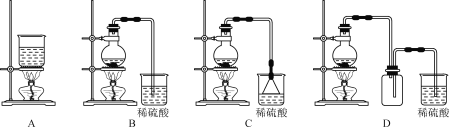
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO 部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、
试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式__________。
(2)装置B的作用是 ①__________,②____________。
(3)若用A装置制取NO气体,B中应该盛放_________。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为___。
(5) 简述检查A、B、C所组成的实验装置气密性的操作_________。
(6)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与________________同时通入NaOH溶液中。
(7)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明 HNO2是弱酸:____________。(仅提供的试剂:1 molL-1HCl、 1 molL-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0 g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,用0.20 molL-1 AgNO3标准溶液滴定至终点,根据表中所给信息,应选用____________做指示剂,滴定终点的现象是______。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3 ×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为________。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去挥发的HCl气体 平衡容器内压强 H2O 2:1 向B和C中加入适量水,使瓶内长导管插入液面以下,分液漏斗中加入适量水后,将漏斗上口活塞打开,再旋转活塞,当有少量水流下后,水不再流下,即说明装置气密性好 O2 用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸上,试纸变蓝,说明HNO2是弱酸 K2CrO4溶液 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化 87.3%
Mn2++Cl2↑+2H2O 除去挥发的HCl气体 平衡容器内压强 H2O 2:1 向B和C中加入适量水,使瓶内长导管插入液面以下,分液漏斗中加入适量水后,将漏斗上口活塞打开,再旋转活塞,当有少量水流下后,水不再流下,即说明装置气密性好 O2 用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸上,试纸变蓝,说明HNO2是弱酸 K2CrO4溶液 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化 87.3%
【解析】
实验室利用浓盐酸和二氧化锰混合加热制氯气,并利用B中饱和食盐水除去挥发的HCl、C中浓硫酸干燥氯气;N2和Cl2一起通E中在常温下生成ClNO,在装置F中经冷却后液化并收集,尾气用氢氧化钠溶液吸收,据此分析解题。
(1)装置A中利用浓盐酸和二氧化锰混合加热制氯气,发生反应的离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)A中制得的氯气混合挥发的HCl,则装置B中饱和食盐水可除去挥发的HCl气体,同时长玻璃管还能平衡B中压强,起稳压作用;
(3) 用A制取NO,A中Cu和稀硝酸反应生成NO,因为硝酸具有挥发性,所以得到的NO中含有硝酸,B中盛放物质能吸收硝酸,稀硝酸溶于水且NO不溶于水,所以B中可以盛放H2O;
(4) 二者反应方程式为Cl2+2NO=2NOCl,二者的流速之比等于其计量数之比即可,则理论上通入NO和Cl2两种气体的流速比为2:1;
(5)检查A、B、C所组成的实验装置气密性的操作是向B和C中加入适量水,使瓶内长导管插入液面以下,分液漏斗中加入适量水后,将漏斗上口活塞打开,再旋转活塞,当有少量水流下后,水不再流下,即说明装置气密性好;
(6)尾气中的Cl2能溶于NaOH,而NO不与水或碱反应,则NO不能被完全吸收,NO和O2反应生成二氧化氮,二氧化氮和水反应生成硝酸,所以可以通入O2;
(7)①若亚硝酸为弱酸,则亚硝酸盐水解呈若碱性,即使用玻璃棒蘸取NaNO2溶液涂抹于红色的石蕊试纸上,若试纸变蓝,则说明亚硝酸为弱酸;
②AgI、AgBr比AgCl更难溶于水,选用KBr或KI作指示剂,最先生成的沉淀可能是AgBr或AgI,则选择K2CrO4溶液为指示剂,滴定终点的现象是:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化,说明反应达到终点;消耗0.20 molL-1AgNO3溶液的体积为20.00ml,其物质的量为0.20 molL-1×0.02L=0.004mol,根据原子守恒,亚硝酰氯(ClNO)的质量分数为 ×100%=87.3%。
×100%=87.3%。

【题目】I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
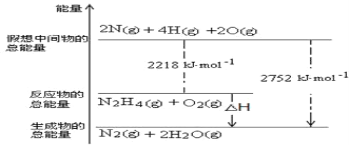
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为__________。
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/molL-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/molL-1min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲____________V丙,平衡常数K丙_________K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)H2NCOONH4(氨基甲酸铵)(l) △H1 ,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
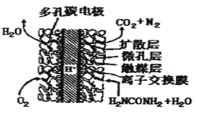
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________。