题目内容
2.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是Na+(钠离子).
(3)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$si(纯)
写出SiCl4的电子式:
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为0.025aKJ
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为0.025aKJ(4)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
分析 (1)a.同一周期,随着原子序数的增大,原子半径逐渐减小,简单离子半径先减小后增大再减小;
b.同一周期元素,随着原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强;
c.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
d.同一周期元素,其单质的熔点先增大后减小;
(2)第三周期中,次外层电子数为8,原子最外层电子书与次外层电子数相同,则该元素为氩;第三周期中简单阳离子为钠离子、镁离子和铝离子,金属的还原性越强,对应离子的氧化性越弱;
(3)四氯化硅为共价化合物,氯原子和硅原子都达到8个电子,每生成1.12kg纯硅需吸收akJ热量,结合物质的量与反应放出的热量成正比计算;
(4)根据题干信息判断该无氧酸盐为氯化钾,再根据化合价变化判断另一种无氧酸盐名称,最后根据化合价升降相等配平即可.
解答 解:(1)a.第三周期中,随着原子序数的递增,原子半径逐渐减小,而离子半径需要根据阴阳离子进行讨论,阳离子只有2个电子层,随着核电荷数在增大,半径逐渐减小,而阴离子有3个电子层,随着核电荷数的增加逐渐减小,但是阴离子半径整体大于阳离子半径,从阳离子到阴离子,半径在增大,故a错误;
b.同一周期中,随着核电荷数的递增,元素的金属性逐渐减弱,非金属性逐渐增强,故b正确;
c.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以其最高价氧化物的水化物碱性减弱、酸性增强,故c错误;
d.同一周期元素,其单质的熔点先增大后减小,Si的熔点最高,故d错误;
故答案为:b;
(2)原子最外层电子书与次外层电子数相同,而第三周期中次外层电子为8,该元素原子结构示意图为 ,则该元素为氩;金属的还原性越强,对应离子的氧化性越弱,所以第三周期中氧化性最弱的为Na+,
,则该元素为氩;金属的还原性越强,对应离子的氧化性越弱,所以第三周期中氧化性最弱的为Na+,
故答案为:氩;Na+;
(3)四氯化硅为共价化合物,氯原子和硅原子都达到8个电子,四氯化硅的电子式为 ,每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为$\frac{a}{\frac{1.12×1{0}^{3}}{28}}$=0.025aKJ,故答案为:
,每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为$\frac{a}{\frac{1.12×1{0}^{3}}{28}}$=0.025aKJ,故答案为: ;0.025aKJ;
;0.025aKJ;
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,则该无氧酸盐为KCl,KCl中氯元素化合价为-1,说明氯酸钾中氯元素化合价降低,则另一种含氧酸盐中氯元素化合价会升高,由于氯酸钾中氯元素化合价为+5,则氯元素化合价升高只能被氧化成高氯酸钾,根据氧化还原反应中化合价升降相等配平该反应为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4,故答案为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
点评 本题考查较综合,涉及同一周期中元素周期律与原子结构的关系、反应热计算、化学方程式的书写等知识,注重高频考点的考查,题目难度较大,有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

| A. | 乙烯中C=C的键能是乙烷中C-C的键能的2倍 | |
| B. | 同一原子中,2p,3p,4p能级的轨道数目依次增多 | |
| C. | C-O键的极性比N-O键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
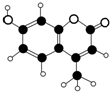 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )①分子式为C10H9O3
②1mol该有机物能与溴水中3mol溴发生取代反应
③该物质含有3种官能团
④能使酸性KMnO4溶液褪色.
| A. | ③④ | B. | ①④ | C. | ②③④ | D. | ①②③④ |
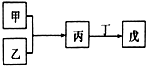 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 | |
| B. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| C. | 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 | |
| D. | 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊 |
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
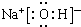 或
或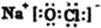 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: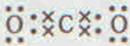 .
.(4)有两种化合物均由①、④、⑤、⑧四种元素形成,两者之间可以相互发生化学反应,其离子反应方程式为:HSO3-+H+=H2O+SO2↑.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
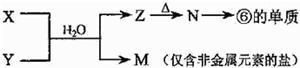
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
| A. | 16 | B. | 18 | C. | 20 | D. | 22 |
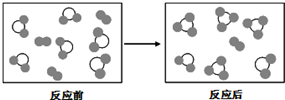
| A. | A2+3B2═2AB3 | B. | 2AB2+B2═2AB3 | C. | 2A2B+5B2=4AB3 | D. | 2AB2+B2=2AB3 |
| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 | |
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| C. | 在一个基态多电子的原子中,M层上的电子能量肯定比N层上的电子能量低 | |
| D. | 在一个基态多电子的原子中,如果某一能级上有多个未成对电子,它们自旋方向必然相同 |