��Ŀ����
����Ŀ��CO ��ԭ������������Ч���������е�NOx���ŷ������ش��������⣺
I��CO ��ԭNO ��������Ӧ��2CO(g)��2NO(g) ![]() 2CO2(g)��N2(g) ��H
2CO2(g)��N2(g) ��H
��1����������ʻ�����л�����к�����CO��NO������֮���ܷ���������Ӧ:
�� �÷�Ӧƽ�ⳣ��K����ʽΪ_________��
�� �÷�Ӧ��K����570 KʱΪ1��1059����������������װ��β������װ�ã������ԭ����_______��
��2����Mn3O4 Ϊ������Ӧ�Ĵ������о���������·�Ӧ���̣������̲���������
��һ����_________��
�ڶ�����3MnO2��2CO��Mn3O4��2CO2
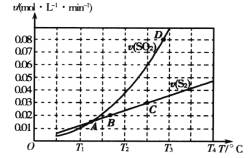
��3���ں��º��ݵ��ܱ������У���������ʵ�����CO ��NO ������壬����Mn3O4 ����������Ӧ��t0 ʱ�ﵽƽ�⣬��÷�Ӧ������CO2 �����������ʱ��Ĺ�ϵ����ͼ��ʾ��
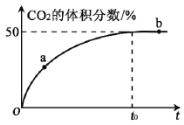
�� �Ƚϴ�С��a��v��______b��v������������������������=����
�� NO ��ƽ��ת����Ϊ_______��
II��T��ʱ���ڸ��Է�Ӧ���з������·�Ӧ��CO(g)��NO2(g) ![]() CO2(g)��NO(g)����ѧ��Ӧ����v =kPm(CO)Pn( NO2)��k Ϊ��ѧ��Ӧ���ʳ������о����������¶��·�Ӧ��ķ�ѹ�뻯ѧ��Ӧ���ʵĹ�ϵ���±���ʾ��
CO2(g)��NO(g)����ѧ��Ӧ����v =kPm(CO)Pn( NO2)��k Ϊ��ѧ��Ӧ���ʳ������о����������¶��·�Ӧ��ķ�ѹ�뻯ѧ��Ӧ���ʵĹ�ϵ���±���ʾ��
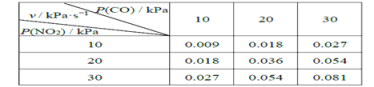
��4������Ӧ��ʼʱP(CO)=P(NO2)=a kPa����Ӧt minʱ�ﵽƽ�⣬�����ϵ��P(NO)=b kPa�����ʱv=_________kPa��s-1���ú���a��b�Ĵ���ʽ��ʾ����ͬ�����÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=_________��Kp���Է�ѹ��ʾ��ƽ�ⳣ������
���𰸡�K=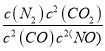 ��ѧ��Ӧ������ Mn3O4��2NO��3MnO2��N2 �� 80 % 9��10-5(a��b)2
��ѧ��Ӧ������ Mn3O4��2NO��3MnO2��N2 �� 80 % 9��10-5(a��b)2 ![]()
��������
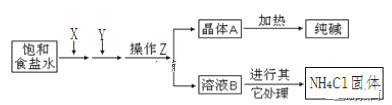
(1)��ƽ�ⳣ��K����������Ũ���ݻ��뷴Ӧ��Ũ���ݻ�֮�ȣ��ڷ�Ӧ��ƽ�ⳣ������(570KʱΪ1��1059)������Ӧ���ʿ��ܼ�����
(2)���ݢ�2CO(g)+2NO(g)2CO2(g)+N2(g)����3MnO2+2CO=Mn3O4+2CO2�������
(3)��a�㷴Ӧ������У�b�㷴Ӧ�ﵽƽ��״̬���ڽ������ʽ��ʽ���㣻
(4)���ݱ������ݷ����жϻ�ѧ��Ӧ����v=k Pm(CO)Pn( NO2)��m=1��n=1���ݴ˼��㻯ѧ��Ӧ���ʳ���k������������ʽ��ʽ���㡣
I��(1)��ƽ�ⳣ��K����������Ũ���ݵĻ��뷴Ӧ��Ũ���ݵĻ�֮�ȣ����Է�Ӧ2NO(g)+2CO(g)N2(g)+2CO2(g)��ƽ�ⳣ��K=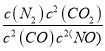 ���ʴ�Ϊ��K=
���ʴ�Ϊ��K=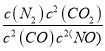 ��
��
�ڷ�Ӧ��ƽ�ⳣ��������Ӧ���ʼ�����װ��β������װ�ÿ���߷�Ӧ���ʣ�������β����ת�����ʣ��ʴ�Ϊ����ѧ��Ӧ��������
(2)��2CO(g)+2NO(g)2CO2(g)+N2(g)����3MnO2+2CO=Mn3O4+2CO2����Mn3O4Ϊ������Ӧ�Ĵ��������-�ڵõ���Ӧ�ĵ�һ����Mn3O4+2NO=3MnO2+N2���ʴ�Ϊ��Mn3O4+2NO=3MnO2+N2��
(3)��a�㷴Ӧ������У�v����v�������ŷ�Ӧ�Ľ��У�����Ӧ������С��b�㷴Ӧ�ﵽƽ��״̬v��=v�������a��v����b��v�����ʴ�Ϊ������
���ں��º��ݵ��ܱ������У���������ʵ�����CO��NO������壬�����ʵ���Ϊ1mol������ͼ��ƽ��ʱ��������̼�������50%�������ɵ���Ϊx��
2CO(g)+2NO(g)2CO2(g)+N2(g)��
��ʼ(mol)1 1 0 0
�仯(mol) 2x 2x 2x x
ƽ��(mol) 1-2x1-2x 2x x
��![]() =50%����ã�x=0.4mol��NO��ƽ��ת����=
=50%����ã�x=0.4mol��NO��ƽ��ת����=![]() ��100%=80%���ʴ�Ϊ��80%��
��100%=80%���ʴ�Ϊ��80%��
(4)��ѧ��Ӧ����v=k Pm(CO)Pn( NO2)��k Ϊ��ѧ��Ӧ���ʳ��������ͼ�����ݵõ���m=1��n=1����ѧ��Ӧ���ʳ���k=![]() ��
��
CO(g)+NO2(g)CO2(g)+NO(g)
��ʼ��/span> a a 0 0
�仯�� b b b b
ƽ���� a-b a-b b b
��ʱv=k P(CO)P( NO2)=![]() ��(a-b)(a-b)=9��10-5(a-b)2����Ӧǰ���������ʵ������䣬����ѹǿ���䣬������������ѹǿ���������ѹ����ƽ�ⳣ������K=
��(a-b)(a-b)=9��10-5(a-b)2����Ӧǰ���������ʵ������䣬����ѹǿ���䣬������������ѹǿ���������ѹ����ƽ�ⳣ������K=![]() ���ʴ�Ϊ��9��10-5(a-b)2��
���ʴ�Ϊ��9��10-5(a-b)2��![]() ��
��

����Ŀ�������ѣ�CH3OCH3����һ�����˻���ԭ�ϣ����м�����Ӧ���ܡ�
I�������ѵ������������ѵ�����ԭ��֮һ�����ü״���ˮ�ɶ����ѣ���ѧ����ʽ���£�
��Ӧi 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ��H 1
CH3OCH3(g) + H2O(g) ��H 1
��1����֪���״��������ѵ���̬��ȼ���ȷֱ�Ϊ-761.5 kJ��mol-1��-1455.2 kJ��mol-1����H2O(g) = H2O(l) ��H����44.0 kJ��mol��1����Ӧi����H 1��_________kJ��mol��1.
��2����Ӧi�м״�ת���ʡ�������ѡ���Եİٷ����벻ͬ�����Ĺ�ϵ���±���ʾ������ʱ��ѡ�����Ѵ�����_________��
���� | �״�ת����/% | ������ѡ����/% |
SiO2-TiO2/SO42- | 35.1 | 98.1 |
SiO2-TiO2/Fe3+ | 52.9 | 98.7 |
GSAL-108 | 81.0 | 98.1 |
SiO2-Al2O3 | 62.1 | 96.4 |
ע����Ӧ��������ѹ���¶�270�����״�Һ�����14mL/(g��h)
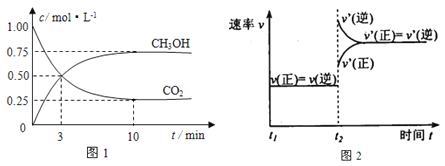
��3��ѡ���������ƽ��ʱ�ļ״�ת�������¶ȵĹ�ϵ��ͼ��ʾ�����о�����ĵ���ɫ��ͼ���ָù�����Ҫ���ڵĸ���ӦΪ��
��Ӧii 2CH3OH(g) ![]() C2H4 (g)+2H2O(g) ��H2����29.1kJ��mol��1
C2H4 (g)+2H2O(g) ��H2����29.1kJ��mol��1
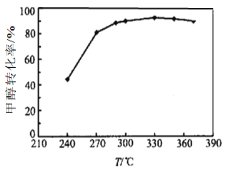
�� ��ҵ�����������ѵ��¶�ͨ����270-300��������330��֮�״�ת�����½���
���ݻ�ѧƽ���ƶ�ԭ��������ԭ�������_________��
���ݻ�ѧ��Ӧ���ʱ仯������ԭ�������_________��
�� ij�¶��£���CH3OH(g)Ϊԭ�ϣ�ƽ��ʱ�����ʵķ�ѹ�������±���
���� | CH3OH(g) | CH3OCH3(g) | C2H4 (g) | H2O(g) |
��ѹ/MPa | 0.16 | 0.288 | 0.016 | �� |
��Ӧi�У�CH3OH(g)��ƽ��ת������=_________������ƽ���ѹ����ƽ��Ũ�ȼ��㣻���������λ��Ч���֡���
II�������ѵ�Ӧ�ã�
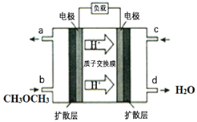
��4����ͼΪ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�����Ĺ���ԭ��ʾ��ͼ���õ�صĸ�����ӦʽΪ��_________��
����Ŀ��A��B��C��D��E��Ϊ������Ԫ�أ���ԭ������������������ݱ�����Ϣ�ش��������⣺
Ԫ�� | Ԫ�����ʻ�ṹ |
A | ���������������ڲ��������2�� |
B | BԪ�صĵ����ڿ����к������ |
C | CԪ���ڵؿ��к������ |
D | DԪ����ͬ�����н�������ǿ |
E | ���³�ѹ�£�EԪ���γɵĵ����ǵ���ɫ���壬���ڻ�ɽ�ڸ������� |
��1��E��Ԫ�����ڱ��е�λ��___��
��2��D������������ˮ���������ѧ�����ͣ�___��___��
��3��B��C��D��E�����Ӱ뾶�ɴ�С˳��Ϊ��___����Ԫ�ط��ţ���
��4���õ���ʽ��ʾE���⻯����γɹ���___��