题目内容
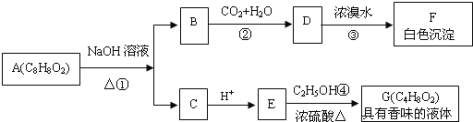
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
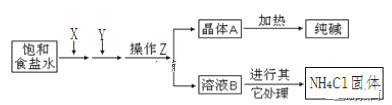
(1)在饱和食盐水中通入X和Y,则X____(填物质名称)
(2)写出通入X和Y的化学反应方程式_____。
(3)操作Z____(填名称),为了得到化肥(NH4Cl),需要在溶液B中通入NH3、加食盐,其中通入NH3的作用一____,作用二____。
(4)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:①称取样品ag,加水溶解;②加入足量的BaCl2溶液;③过滤、___、烘干、冷却、称量、烘干、冷却、___,最终得到固体bg。样品中纯碱的质量分数为____(用含a、b的代数式)
(5)某课外活动小组要用NaOH溶液和CO2来制备Na2CO3固体,他们只有未知浓度的NaOH溶液50毫升和足量的CO2,他们的设计方案是:首先_____,然后_____,加热_____后,再____,最后加热浓缩,冷却结晶,过滤得固体Na2CO3 。
【答案】氨气 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 过滤(洗涤) 将NaHCO3转化为Na2CO3 产生的NH4+有利于NH4Cl形成 洗涤 (再)称量 106b/197a 将50毫升NaOH溶液分成两等份 向其中的一份中通入过量的CO2 除去CO2 与另一份NaOH溶液混合
【解析】
(1)二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,增加二氧化碳气体的吸收;
(2)碳酸氢钠的溶解度比碳酸钠小,二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体;
(3)过滤后得到的物质有杂质,需要进行洗涤;滤液(溶液B)是含有氯化铵、氯化钠和少量碳酸氢钠的溶液,通入 NH3,增大NH4+的浓度,使 NH4Cl 更多地析出,使 NaHCO3转化为溶解度更大的Na2CO3,提高析出的NH4Cl;
(4)通过称量沉淀碳酸钡的质量,根据原子守恒来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且需干燥,恒重,样品中纯碱的质量分数,根据碳守恒计算。
(5)不能直接向氢氧化钠中直接通入CO2,这样会生成碳酸氢钠溶液,但碳酸氢钠与氢氧化钠可以反应生成碳酸钠。
联合制碱法:以食盐、氨和二氧化碳为原料来制取纯碱,二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,X为氨气,Y为二氧化碳,反应为:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl,经过滤(操作 z)、洗涤得NaHCO3微小晶体(晶体A),再加热制得纯碱产品,其滤液(溶液B)是含有氯化铵和氯化钠的溶液,从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。
(1)二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收;
(2)碳酸氢钠的溶解度比碳酸钠小,二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体;
(3)①固体、液体分离采用过滤的方法,沉淀表面有杂质,需要进行洗涤,所以操作Z可以是洗涤也可以过滤;②滤液(溶液B)是含有氯化铵、氯化钠和少量碳酸氢钠的溶液,通入 NH3,增大NH4+的浓度,使 NH4Cl 更多地析出,使 NaHCO3转化为溶解度更大的Na2CO3,提高析出的NH4Cl;
(4)加入足量的BaCl2溶液,发生反应:Na2CO3+BaCl2=BaCO3![]() +2NaCl,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,恒重操作(再)称量后最终得到固体b(g)为BaCO3,根据碳守恒,纯碱的质量分数=
+2NaCl,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,恒重操作(再)称量后最终得到固体b(g)为BaCO3,根据碳守恒,纯碱的质量分数=![]() 100%;
100%;
(5)不能直接向氢氧化钠中直接通入CO2,这样会生成碳酸氢钠溶液,但碳酸氢钠与氢氧化钠可以反应生成碳酸钠,所以先向溶液中通入二氧化碳气体后,在让其与氢氧化钠反应就可以得到碳酸钠溶液。

【题目】四氯化锡常作有机合成的催化剂。实验室用熔融的锡(熔点为231.9 ℃)与氯气反应制备SnCl4。装置如图所示(加热装置省略)。
已知:①SnCl4、SnCl2有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
③在常温下,用KClO3和浓盐酸反应制备氯气。
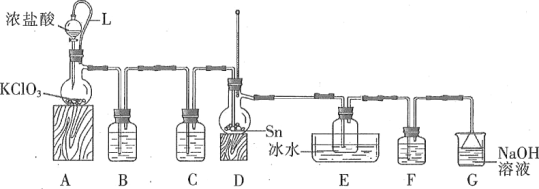
(1)写出装置A中发生反应的化学方程式:_____。
(2)下列说法不正确的是____。(填字母)
A.F和C中试剂相同,E中的冰水冷却产品
B.导管L平衡气压,使浓盐酸顺利下滴
C.先通入氯气,当D充满黄绿色气体时加热烧瓶
D.除去产品中氯气的方法是加入SnCl2溶液
(3)用化学方程式表示拆去F装置对实验的影响:_____。
(4)F和G装置可以用下列装置代替的是____。(填代号)
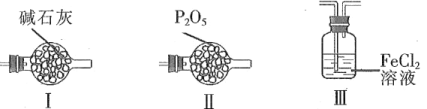
(5)加热D使锡熔融后需要继续加热,其一为了加快锡与氯气反应,其二为了____。
(6)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液VmL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量___(填“偏高”“偏低”或“无影响”)。
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-