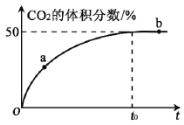
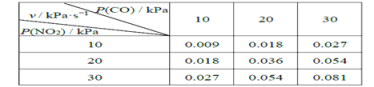
题目内容
【题目】A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置___。
(2)D的最高价氧化物的水化物,所含化学键类型:___、___。
(3)B、C、D、E简单离子半径由大到小顺序为:___(填元素符号)。
(4)用电子式表示E的氢化物的形成过程___。
【答案】第三周期第ⅥA族 离子键 共价键 S2->N3->O2->Na+ ![]()
【解析】
A、B、C、D、E均为短周期元素,且原子序数依次增大,由最外层电子数是其内层电子数的2倍可知,A为C元素;由B元素的单质在空气中含量最多可知,B为N元素;由C元素在地壳中含量最多可知,C为O元素;由D元素在同周期中金属性最强可知,D为Na元素;由常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积可知,E为S元素。
(1)E为S元素,位于元素周期表第三周期ⅥA族,故答案为:第三周期ⅥA族;
(2)D为Na元素,最高价氧化物的水化物为氢氧化钠,氢氧化钠是离子化合物,含有离子键和共价键,故答案为:离子键;共价键;
(4)B是N元素、C是O元素、D是Na元素、E是S元素,由电子层数越多,离子半径越大可知,具有三个电子层的S2-离子半径最大,N3-、O2-、Na+具有相同的电子层结构,都有2个电子层,由电子层结构相同的离子,原子序数大,离子半径越小可知,离子半径N3->O2->Na+,则四种离子的离子半径由大到小顺序为S2->N3->O2->Na+,故答案为:S2->N3->O2->Na+;
(4)E的氢化物为共价化合物H2S,用电子式表示H2S的形成过程为![]() ,故答案为:
,故答案为:![]() 。
。

 发散思维新课堂系列答案
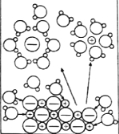
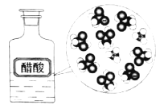
发散思维新课堂系列答案【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
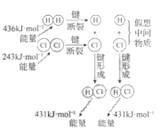
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D