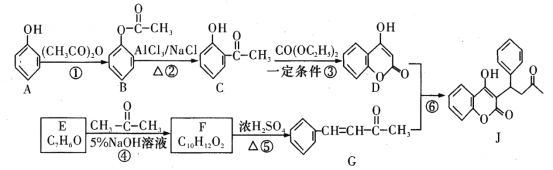
题目内容
【题目】下列说法中正确的是( )
A.将0.1molCuSO45H2O晶体加入到100mL水中,该溶液物质的量浓度为1molL-1
B.一定体积的浓硫酸(其中含0.2molH2SO4)与足量的铜共热反应,生成SO2气体0.1mol
C.将34.2gAl2(SO4)3溶于水配成100mL溶液[Al2(SO4)3的式量为342],取出10mL该溶液中Al3+浓度为1molL-1
D.KCl溶液的密度为1.174gcm-3,物质的量浓度为4.0molL-1,则此溶液中KCl的质量分数为![]() ×100%
×100%
【答案】D
【解析】
A.将0.1molCuSO45H2O晶体加入到100mL水中,配成的溶液体积不是100mL,溶液物质的量浓度不是1molL-1,故A错误;
B.Cu与浓硫酸反应,随着反应的进行,硫酸浓度变稀,而稀硫酸与Cu不反应,由Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O可知,含0.2molH2SO4的浓硫酸与足量的铜共热反应,生成SO2气体小于0.1mol,故B错误;
CuSO4+SO2↑+2H2O可知,含0.2molH2SO4的浓硫酸与足量的铜共热反应,生成SO2气体小于0.1mol,故B错误;
C.34.2gAl2(SO4)3的物质的量为![]() =0.1mol,溶于水配成100mL溶液,所得Al2(SO4)3溶液浓度为1mol/L,Al3+浓度为2mol/L,溶液是均匀的,取出10mL溶液的浓度与原溶液浓度相等,Al3+浓度为2mol/L,故C错误;
=0.1mol,溶于水配成100mL溶液,所得Al2(SO4)3溶液浓度为1mol/L,Al3+浓度为2mol/L,溶液是均匀的,取出10mL溶液的浓度与原溶液浓度相等,Al3+浓度为2mol/L,故C错误;
D.KCl溶液的密度为1.174gcm-3,物质的量浓度为4.0molL-1,根据c=![]() 可知,此溶液中KCl的质量分数为
可知,此溶液中KCl的质量分数为![]() ×100%,故D正确;
×100%,故D正确;
故选D。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1个 |
C元素原子的第一至第四电离能分别是:I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)B基态原子中能量最高的电子,其电子云在空间有_____个方向,原子轨道呈___形
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为![]()
![]() 该同学所画的电子排布图违背了____。
该同学所画的电子排布图违背了____。
(3)G位于______族______区,价电子排布式为______。
(4)检验F元素的实验方法是_________。