��Ŀ����
����Ŀ������������һ�ֳ�����ʳƷ���Ӽ���Ϊ����ijʳƷ���������κ�����ͨ����1kg��Ʒ�к�SO2�����ƣ���ij�о�С��ͬѧ���������ʵ�鷽����
I.��ȡ��ƷWg���������ϡ���
II.��I�в�����SO2������H2O2��Һ���գ�
III.��II������Һ��0.lmolL-1����������Һ�ζ����������ΪVmL��
IV.���ݴ�����
������С��ͬѧ��ʵ�����ơ����������ݴ�����������ȷ����( )
A.����I�п���ϡ�������ϡ����
B.1kg��Ʒ�к�SO2������Ϊ![]() g
g
C.��������ˮ���滻II�е���������H2O2��Һ�����Բⶨ�����Ӱ��
D.����I�����ɵ�SO2������װ����δ��H2O2��Һ���գ����ܵ��²���������κ���ƫ��
���𰸡�D
��������
I.�з�����Ӧ��![]() ��II. �з�����Ӧ��
��II. �з�����Ӧ��![]() ��III. �з�����Ӧ��
��III. �з�����Ӧ��![]() ,�ɴ˿�֪����֮���ת�����̼���ϵΪ��
,�ɴ˿�֪����֮���ת�����̼���ϵΪ��![]() ���ݴ˽��
���ݴ˽��
A.����I�в�����ϡ�������ϡ���ᣬ��Ϊ�������ǿ�����ԣ��ܽ�������������������Ӷ��ò�����������A����
B.�ɴ˿�֪����֮���ת�����̼���ϵΪ��![]() ��n(NaOH) =
��n(NaOH) =![]() ����Wg��Ʒ��
����Wg��Ʒ��![]() ��1kg��Ʒ�к�SO2������Ϊ
��1kg��Ʒ�к�SO2������Ϊ![]() g����B����
g����B����
C.��������ˮ���滻II�е���������H2O2��Һ������������ˮ�������������ƣ�����������������ƫ�ߣ����⺬��ƫ�ߣ���C����
D.����I�����ɵ�SO2������װ����δ��H2O2��Һ���գ������������������ƫ�ͣ�������������ƫ�ͣ�������ƫ�ͣ���D��ȷ��
��ѡ��D��

 һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д� ��Ч���ܿ�ʱ��ҵϵ�д�
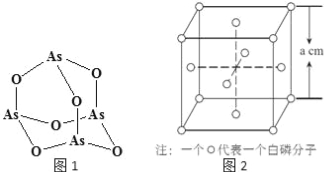
��Ч���ܿ�ʱ��ҵϵ�д�����Ŀ���ú����̽��(��Ҫ�ɷ�ΪMnO2��������MgO��Fe2O3��Al2O3��SiO2)Ϊԭ�ϣ��Ʊ������̡�þ��һ�ֹ�������·�����£�
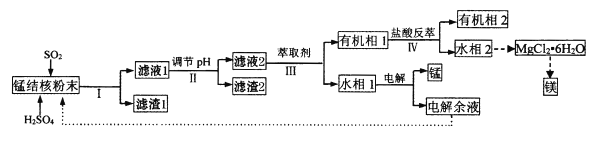
��֪���ټ�����������ܶȻ�(25��)���±���ʾ��
��ѧʽ | Mg(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 |
Ksp | 1.8��10-11 | 1.8��10-13 | 1.0��10-33 | 4.0��10-38 |
����Һ��ij����Ũ����1.0��10-6mol��L-1ʱ����Ϊ�����ӳ�����ȫ��
����������⣺
(1)���̽�˷�ĩ����MnO2��SO2��Ӧ�����ӷ���ʽΪ_____��
(2)����Һ1����c(Mn2+)Ϊ0.18mol��L-1������pH���ķ�ΧΪ_______��������2���ijɷ�Ϊ______��
(3)������������ȡ������ȡ�ijɷ���___�����������á����ᷴ�͡���������____��
(4)MgCl2��6H2O��ȡ��ˮMgCl2ʱ����Ҫ�ڸ����HCl�����м��ȷֽ⡣HCl������Ϊ__________��
(5)�ù��������г������Һ��ѭ�������⣬����ѭ�����õ��Լ�Ϊ____��
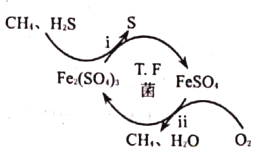
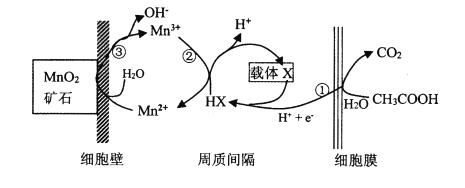
(6)һ�ֺ����ٵ��߾�(����̫ƽ�����)���������������Դ���Ϊ���ӹ��廹ԭMnO2����Mn2+�Ļ�����ͼ��ʾ��д����Ӧ�ڢ۵��ܷ�Ӧ�����ӷ���ʽ____________��
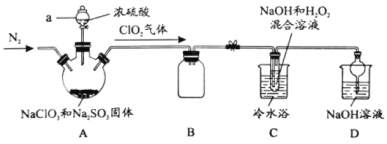
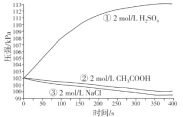
����Ŀ��̽�������ڲ�ͬ��Һ�еĸ�ʴ�����ʵ��װ�����������£�
ʵ��װ�� | ʵ������ |
|
|
����˵������ȷ����
A.�ٵĸ�����Ӧ��Fe-3e-=Fe3+
B.�۵�������Ӧ��O2+2H2O+4e-=4OH-
C.�ڿ���ͬʱ�������ⸯʴ��������ʴ
D.�����ĵ绯ѧ��ʴ����������Ϊ������Һ��pH�й�