题目内容
(8分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加入B(体积不变),则A的转化率_________,B的转化率_________。(填“增大”“减小”或“不变”,下同)
(3)若升高温度,则平衡时B、C的浓度之比 将_________。
将_________。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:(1) m+n_________p(填“>”“=”“<”)。
(2)若加入B(体积不变),则A的转化率_________,B的转化率_________。(填“增大”“减小”或“不变”,下同)
(3)若升高温度,则平衡时B、C的浓度之比
 将_________。
将_________。(8分)(1) > (2)增大 减小 (3)减小
(1)当升高温度时,B的转化率变大,所以正反应是吸热反应;当减小压强时,混合体系中C的质量分数减小,说明正反应是体积减小的反应,所以m+n>P。
(2)增大B的浓度,平衡向正反应方向移动,所以A的转化率增大,但B的转化率减小。
(3)正反应是吸热的,所以升高温度,平衡向正反应方向移动,因此B、C的浓度之比将减小。
(2)增大B的浓度,平衡向正反应方向移动,所以A的转化率增大,但B的转化率减小。
(3)正反应是吸热的,所以升高温度,平衡向正反应方向移动,因此B、C的浓度之比将减小。

练习册系列答案
相关题目
 N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的
N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( ) CO(g)+3H2(g)
CO(g)+3H2(g) 2YX3(g) △H
2YX3(g) △H 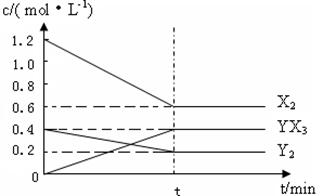
 Y(g)+Z(s),以下能说明反应达到平衡标志的是
Y(g)+Z(s),以下能说明反应达到平衡标志的是 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
 2SO3(g);△H= -197 kJ/ mol,当达到平衡状态时,下列说法中正确的是( )
2SO3(g);△H= -197 kJ/ mol,当达到平衡状态时,下列说法中正确的是( )