题目内容
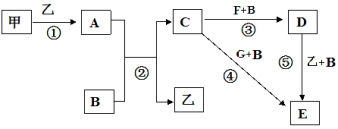
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。
(2)反应⑤的化学方程式为____________________________。
(3)甲与B反应的离子方程式 ______________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是_____________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________。
【答案】(1)①⑤
(2)4Fe(OH)2+O2+2H2O = 4Fe(OH)3
(3)2Na + 2H2O = 2Na++2OH- + H2↑
(4)产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀
(5)4Fe2++4Na2O2+6H2O=4Fe(OH)3+8Na++O2↑
【解析】
试题分析:甲、乙为单质,二者反应生成A为淡黄色固体,则A为Na2O2,甲、乙分别为Na、氧气中的一种;B为常见液态化合物,与A反应生成C与乙,可推知B为H2O、乙为氧气、C为NaOH,则甲为Na;F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色,则G为FeCl3,F为FeCl2,结合转化关系可知,E为Fe(OH)3,D为Fe(OH)2,
(1)反应①~⑤中,①②⑤属于氧化还原反应,③④属于非氧化还原反应;①⑤属于化合反应。故答案为:①⑤;
(2)反应⑤的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)甲与B反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑。
(4)在空气中将NaOH溶液滴入FeCl2溶液中,先生成氢氧化亚铁沉淀,再被氧化生成氢氧化铁,观察
到的现象是:先生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色。
(5)在FeCl2溶液中加入等物质的量的Na2O2,发生反应的总的离子方程式为:4Fe2++4Na2O2+6H2O=4Fe(OH)3+8Na++O2↑。

【题目】
A.在500 mL容量瓶中配制500 mL烧碱溶液 |
B.用移液管(或碱式滴定管)量取50.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂 |
C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解 |
D.将物质的量浓度为c mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1mL |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL 请完成下列问题:
(1)正确的操作步骤是(填写字母)________→________→________→D→________.
(2)滴定管读数应注意_______________________.
(3)操作中锥形瓶下垫一张白纸的作用是___________________.
(4)操作D中液面应调整到________________________;尖嘴部分应____________.
(5)滴定到终点时锥形瓶内溶液的pH约为___________;终点时的颜色变化是________.
(6)若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响________(填“偏高”、“偏低”或“无影响”,其他操作均正确).
(7)该烧碱样品的纯度计算式是__________________.
【题目】某合金与铁的物理性质的比较见下表:
熔点(℃) | 密度/(g·cm-3) | 硬度(金 刚石为10) | 导电性 (银为100) | |
某合金 | 2 500 | 3.00 | 7.4 | 2.3 |
铁 | 1 535 | 7.86 | 4.5 | 17 |
还知该合金耐腐蚀、强度大,从以上性能看,该合金不适合做( )
A. 导线 B. 门窗框
C. 炉具 D. 飞机外壳