题目内容
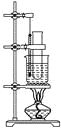
【题目】某化学小组进行Na2O2与水反应的实验,如下图所示,该小组对试管c中红色褪去的原因进行探究。
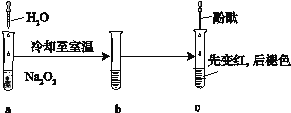
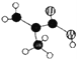
(1)Na2O2中含有的化学键类型:__________;请写出a中反应的化学方程式______。
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2+ H2O =" NaOH" + H2O22H2O2= 2H2O + O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中,____________,证明溶液中有H2O2残留。
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
①_____________________;
② 溶液中H2O2破坏酚酞的结构;
③ NaOH和H2O2共同作用结果。
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
实验 | 操作 | 现象 | 结论 |
1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ①___________ |
2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 |
|
3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12…… | ②_____________________________…… | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
(5)某同学按取(4)中述实验2褪色后的溶液,加水稀释至pH=12,没有观察到溶液变红。该同学推测实验2加盐酸后溶液变红还可能与温度有关,请写出理由:___________。
【答案】离子键、非极性共价键 2Na2O2 + 2H2O = 4NaOH + O2↑ 加入少量MnO2粉末,产生大量气泡,用带火星的木条检验,木条复燃 溶液中NaOH浓度较大,pH≥13 仅H2O2不能破坏酚酞结构,酚酞褪色是H2O2和NaOH共同作用结果(或 假设②不正确,假设③正确) 溶液先变红,后褪色; 加入稀盐酸,会因发生中和反应而放热,使溶液温度升高
【解析】
(1)Na2O2中含有的化学键类型有离子键、非极性共价键;Na2O2与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2 + 2H2O = 4NaOH + O2↑
(2)证明过氧化氢的存在,利用其在二氧化锰作催化剂的条件下发生分解反应,生成氧气来判断。操作步骤是加入少量MnO2粉末,产生大量气泡,用带火星的木条检验,木条复燃。
(3)当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;所以① 的假设是溶液中NaOH浓度较大,pH≥13;
(4)实验1的现象说明①仅H2O2不能破坏酚酞结构,酚酞褪色是H2O2和NaOH共同作用结果;
实验3的结论说明Na2O2与水反应后的溶液(pH=14>13),所以滴加2滴酚酞先变红后褪色;加入盐酸使氢氧根离子浓度减小,又出现红色,pH在8~13时,NaOH和H2O2共同作用使溶液褪色,所以最终溶液褪色。
(5)加水稀释不变红,加盐酸后变红,因为加盐酸后发生中和反应,中和反应是放热反应,体系温度升高,溶液红色出现。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案【题目】已知酸性条件下有如下反应:![]() 由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或
由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或![]() ,两者都是红色固体.一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
,两者都是红色固体.一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
实验现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物是![]()
A.CuB.![]()
C.一定有Cu,可能有![]() D.一定有
D.一定有![]() ,可能有Cu
,可能有Cu
【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:

已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:____________________________。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是_______________(填化学式)。
(3)除杂步骤中加入的MnCO3的作用是____________________________,该过程需调节溶液pH的范围是___________________________,若把pH调得过高,其后果是_________________________。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为____________________,电解后阳极的电解质溶液可返回_______________________(填“酸浸”“除杂”或“电解”)工序继续使用。