题目内容
14.在下列物质中:①CO2 ②CCl4 ③NH3 ④BF3 ⑤H2O ⑥HBr中,分子中电荷的空间分布均匀的是( )| A. | ①②④ | B. | ②④⑤ | C. | ③⑤⑥ | D. | ①②⑤ |
分析 同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键;分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子,
对于ABn型分子,A原子的最外层电子,若完全成键,属于非极性分子,分子中电荷的空间分布均匀,若不完全成键,则属于极性分子,分子中电荷的空间分布不均匀,据此分析解答.
解答 解:①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子,分子中电荷的空间分布均匀;
②CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子,分子中电荷的空间分布均匀;
③NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子,分子中电荷的空间分布不均匀;
④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子,分子中电荷的空间分布均匀;
⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子,分子中电荷的空间分布不均匀;
⑥HBr为直线型结构,含有极性键,为极性分子,正负电荷的重心不重合,电荷分布不均匀;
故选A.
点评 本题以分子中电荷的空间分布均匀为载体考查了分子极性和化学键极性的判断,题目难度不大,注意ABn型分子极性判断技巧.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.某化学兴趣小组用图所示装置制备干燥纯净的氯气,并探究氯气的性质.请回答下列问题:
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于0.5mol(选填“大于”、“小于”、“等于”).
(2)兴趣小组的同学准备在F中装入FeCl2溶液以验证Cl2的氧化性,则该反应的化学方程式2FeCl2+3Cl2=2FeCl3.
(3)兴趣小组同学一致认为氯气能使湿润的红色布条褪色,但对于使湿润的红色布条褪色的原因看法不一致,为探究原因,特设计下列实验.(已知:Cl2+H2O?HCl+HClO)
(4)兴趣小组的某同学认为整套实验装置还存在一处明显缺陷,该缺陷是缺乏尾气处理装置.
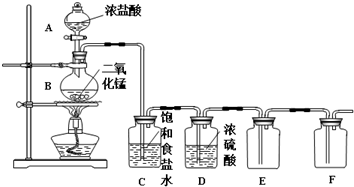
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于0.5mol(选填“大于”、“小于”、“等于”).
(2)兴趣小组的同学准备在F中装入FeCl2溶液以验证Cl2的氧化性,则该反应的化学方程式2FeCl2+3Cl2=2FeCl3.
(3)兴趣小组同学一致认为氯气能使湿润的红色布条褪色,但对于使湿润的红色布条褪色的原因看法不一致,为探究原因,特设计下列实验.(已知:Cl2+H2O?HCl+HClO)
| 提出假设 | 验证假设 | 得出结论 |
| ①能使红色布条褪色是HCl ②能使红色布条褪色是HClO ③能使红色布条褪色是Cl2(写化学式) | 实验①:把红色布条伸入稀盐酸中,红色布条不褪色. 实验②:E、F分别装入A(填标号),干燥的红色布条不褪色,湿润的红色布条褪色. A.干燥的红色布条、湿润的红色布条 B.湿润的红色布条、干燥的红色布条 | 氯水中的HClO (写化学式)能使湿润的红色布条褪色. |

2.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ、向粗盐水中加入过量BaCl2溶液,操作X;
Ⅱ、向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ、滤液用盐酸调节pH,获得第一次精制盐水.
(1)操作X使用的主要仪器为:漏斗、烧杯、玻璃棒.
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全.
②过程Ⅱ之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,检验Ba2+的操作是取少量清液放置于试管中,先加入盐酸,再加入硫酸钠溶液,若无白色沉淀,则可证明溶液无Ba2+.
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去NH4+的离子方程式是3ClO-+2NH4+=3Cl-+N2↑+2H++3H2O.
②实验室从水溶液分离出I2的操作名称为萃取.
③过程Ⅵ中,产品NaOH在电解槽的阴极区生成(填“阳极”或“阴极”),该电解槽为阳离子交换膜电解槽(填“阳”或“阴”).
Ⅰ、向粗盐水中加入过量BaCl2溶液,操作X;
Ⅱ、向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ、滤液用盐酸调节pH,获得第一次精制盐水.
(1)操作X使用的主要仪器为:漏斗、烧杯、玻璃棒.
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②过程Ⅱ之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,检验Ba2+的操作是取少量清液放置于试管中,先加入盐酸,再加入硫酸钠溶液,若无白色沉淀,则可证明溶液无Ba2+.
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去NH4+的离子方程式是3ClO-+2NH4+=3Cl-+N2↑+2H++3H2O.
②实验室从水溶液分离出I2的操作名称为萃取.
③过程Ⅵ中,产品NaOH在电解槽的阴极区生成(填“阳极”或“阴极”),该电解槽为阳离子交换膜电解槽(填“阳”或“阴”).
9.化学与社会、生产、生活密切相关,下列说法正确的是( )
| A. | 神舟飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 | |
| B. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| C. | 乙醇和汽油都是可再生能源,应大力推广使用乙醇汽油 | |
| D. | “辽宁舰”上用于舰载机降落的拦阻索是一种特种钢缆,属新型无机非金属材料 |
19.2008年9月25日晚9时10分,我国“神舟七号”载人飞船顺利升入太空.此次火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4═3N2↑+4H2O↑+2CO2↑,下列叙述错误的是( )
| A. | 此反应是氧化还原反应 | |
| B. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| C. | 在反应中N2O4做还原剂 | |
| D. | R的分子式为C2H8N2 |
3.与乙烷作为同系物的是( )
| A. | C4H8 | B. | C2H4 | C. | C8H20 | D. | C12H26 |
4.下列热化学方程式中△H的数值表示可燃物燃烧热的是( )
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1 |