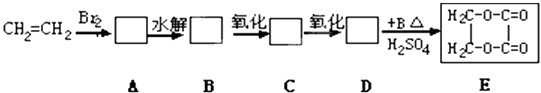
题目内容
【题目】化学实验是进行科学探究、探求新知识的重要途径.某学习小组的同学设计如图装置探究铜片与浓硫酸的反应(加热、夹持装置略去). 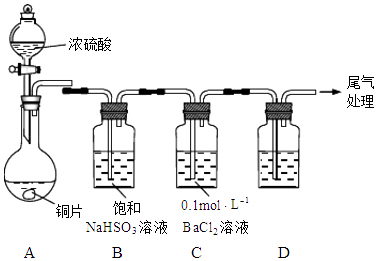
(1)探究I SO2的性质: A中铜片与浓硫酸的反应方程式为: .
(2)实验进行一段时间后,发现C中产生白色沉淀,经检验该沉淀为BaSO4 . 同学甲分析:A中温度过高,产生副产物SO3 , SO3进入C中与BaCl2反应生成BaSO4 . 你认为甲的分析合理吗?请说明理由. .
(3)若用装置D检验SO2的漂白性,则D中溶液是;处理尾气可用 . (填试剂名称)
(4)探究II 关于浓硫酸: 为测定浓硫酸的浓度,同学乙设计如下方案:
取适量该浓硫酸,稀释10倍后取出20mL置于锥形瓶中,滴入2滴酚酞作指示剂,用标准NaOH溶液进行滴定.如果装标准液的滴定管未用标准液润洗,会导致测定结果;如果锥形瓶用待测液润洗,会导致测定结果 . (填“偏高”、“偏低”或“不受影响”)
(5)为测定A中参加反应的硫酸的物质的量,同学丙设计如下方案: 待A中铜片完全溶解,冷却后将溶液稀释至500mL,再加入过量铁粉,使之充分反应,生成的气体在标况下的体积为16.8L;过滤得到残留固体,经洗涤、干燥、称量,比原铁粉质量减轻了35.6g.则A中参加反应的硫酸为mol.
【答案】
(1)Cu+2H2SO4![]() ?CuSO4+SO2↑+2H2O
?CuSO4+SO2↑+2H2O
(2)不合理,因为铜与浓硫酸反应生成的二氧化硫与空气中的氧气一起与BaCl2溶液反应生成BaSO4
(3)品红试液;氢氧化钠
(4)偏高;偏高
(5)2.35
【解析】解:(1)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4 ![]() CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,
所以答案是:Cu+2H2SO4 ![]() CuSO4+SO2↑+2H2O;(2)浓硫酸在温度过高条件下,不会产生SO3,而是因为铜与浓硫酸反应生成的二氧化硫与空气中的氧气一起与BaCl2溶液反应生成BaSO4,
CuSO4+SO2↑+2H2O;(2)浓硫酸在温度过高条件下,不会产生SO3,而是因为铜与浓硫酸反应生成的二氧化硫与空气中的氧气一起与BaCl2溶液反应生成BaSO4,
所以答案是:不合理,因为铜与浓硫酸反应生成的二氧化硫与空气中的氧气一起与BaCl2溶液反应生成BaSO4;(3)检验二氧化硫漂白性可以通过品红试液,品红褪色是二氧化硫气体的特性,二氧化硫为酸性氧化物,与氢氧化钠反应生成亚硫酸钠,可以用氢氧化钠吸收二氧化硫,
所以答案是:品红试液;氢氧化钠;(4)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小,滴定时消耗的氢氧化钠的体积偏高,所以计算结果偏大;锥形瓶水洗后用待测液润洗,导致待测液的物质的量增加,造成V(标准)偏大,所以计算结果偏高,
所以答案是:偏高;偏高;(5)设加入Cu片的量为xmol,n(H2)= ![]() =0.75mol
=0.75mol
Cu+ | 2H2SO4(浓) | CuSO4+SO2↑+2H2O |
xmol | 2xmol | xmol |
CuSO4+ | Fe═FeSO4+ | Cu; | Fe+ | H2SO4═FeSO4+ | H2↑ |
xmol | xmol | xmol | 0.75mol | 0.75mol | 0.75mol |
由Fe溶解,产生Cu质量减轻35.6g可得:56g/mol×(xmol+0.75mol)﹣64g/mol×xmol=35.6g
∴x=0.8mol
原 H2SO4的物质的量n(H2SO4)=2×0.8mol+0.75mol=2.35mol
所以答案是:2.35.