题目内容
某混合溶液中可能大量含有的离子如下表所示:
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。

(1)该溶液中一定含有的阳离子是______________,其
对应物质的量浓度之比为________,溶液中一定不
存在的阴离子是_____________。
(2)请写出沉淀减少的离子方程式_____________________。
(1)H+、Al3+、NH4+、Mg2+(2分);2:2:2:3(2分);OH-、CO32-、AlO2-(2分)
(2)Al(OH)3+OH-= AlO2-+2H2O(2分)
解析试题分析:(1)加入0~amol过氧化钠时,没沉淀生成,表明溶液中含有H+;从a~bmol沉淀量增加,从b~8mol沉淀粉的量不变,但是气体的量增加,表明一定含有NH4+;从8~cmol沉淀的量减少,表明溶液中一定含有Al3+;但是并没有溶解完,表明原溶液中还含Mg2+。因此含有的离子为:H+、Al3+、NH4+、Mg2+;溶解2mol的氢氧化铝需用氢氧化钠2mol,表明铝离子为2mol,那么镁离子为3mol,8mol的过氧化钠能生成16mol的氢氧化钠, b-a=12mol;16-2×3-3×2=4mol,也就是说,氢离子跟铵根离子总的物质的量为4mol。8mol的过氧化钠还生成4mol的氧气,因此氨气为2mol,那么铵根离子为:2mol,所以氢离子为2mol。所以:n(H+)﹕n(Al3+)﹕n(NH4+)﹕ n(Mg2+)= 2:2:2:3;溶液中一定不存在的离子是:OH-、CO32-、AlO2-。(2)Al(OH)3+OH-= AlO2-+2H2O(2分)
考点:考查离子之间的反应。

练习册系列答案
相关题目
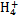 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C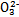 、S
、S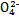 、Cl-、N
、Cl-、N 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下: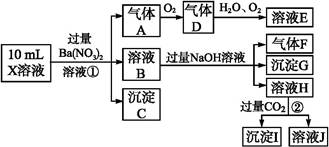
 Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O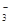 、SO
、SO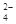 、NH
、NH 、CO
、CO (不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验: