题目内容
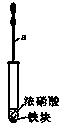
(8分)探究有关物质氧化性的强弱。Bi位于元素周期表中第VA族,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行实验,现象记录如下:①滴加适量的NaBiO3溶液,溶液变为紫红色;②继续滴加适量H2O2, 紫红色褪去,并有气泡产生;③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;④最后通入足量的SO2气体。请回答下列问题:
(1)推测实验④中现象为 。
(2)分析上述现象,KMnO4、H2O2、PbO2的氧化性由强到弱的顺序是 。
(3)写出②的离子方程式 。
(4)写出④的离子方程式 。
(1)推测实验④中现象为 。
(2)分析上述现象,KMnO4、H2O2、PbO2的氧化性由强到弱的顺序是 。
(3)写出②的离子方程式 。
(4)写出④的离子方程式 。
(1)紫红色褪去,溶液变为无色 。
(2)PbO2>KMnO4>H2O2 。
(3)2 MnO4-+5 H2O2+6H+ = 2Mn2++5O2↑+ 8H2O 。
(4)2 MnO4-+5 SO2+2H2O = 2Mn2++5 SO42-+ 4 H+ 。
(2)PbO2>KMnO4>H2O2 。
(3)2 MnO4-+5 H2O2+6H+ = 2Mn2++5O2↑+ 8H2O 。
(4)2 MnO4-+5 SO2+2H2O = 2Mn2++5 SO42-+ 4 H+ 。
略

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
 (用离子方程式表示),
(用离子方程式表示),