��Ŀ����
����Ŀ����ѧʵ��������ͼ��ʾװ����ȡ�����屽������д���пհס�
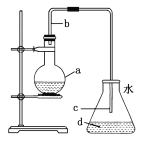
(1)����ƿa��װ���Լ��DZ��������м������b��������������һ�ǵ��������Ǽ���________�����á�
(2)��Ӧ�������ڵ���c���¿ڸ������Թ۲쵽�������֣��������ڷ�Ӧ���ɵ�________��ˮ�������γɵġ�
(3)��Ӧ��Ϻ�����ƿd�е���AgNO3��Һ����________���ɡ�
(4)��Ӧ��Ϻ���ƿa�е�Һ�嵹��ʢ����ˮ���ձ�����Թ۲쵽�ձ��ײ���________ɫ������ˮ��Һ�塣�����ܽ���________�Ĵ��屽��
(5)д����ƿa�з�����Ӧ�Ļ�ѧ����ʽ��____________________��
���𰸡�(1)�������� (2)HBr
(3)����ɫ����(��AgBr����) (4)�� ��
![]()
��������(1)����b��������������һ�ǵ�����������������(�������ܡ�������)��
(2)�а������֣�����Ϊ��Ӧ���ɵ�HBr��ˮ�������γɵ�СҺ�Ρ�
(3)����ƿd�еμ�AgNO3��Һ������dz��ɫ�������ɣ����ӷ���ʽΪAg����Br��===AgBr����
(4)�ձ��ײ��к�ɫ������ˮ��Һ�壬������Ϊ�屽���ܽ��������塣���屽Ϊ��ɫҺ�壬�ܶȱ�ˮ��

 ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH���±���
ʵ���� | HA���ʵ��� Ũ��(mol��L��1) | NaOH���ʵ��� Ũ��(mol��L��1) | ����� Һ��pH |
�� | 0.1 | 0.1 | pH��9 |
�� | c | 0.2 | pH��7 |
�� | 0.2 | 0.1 | pH<7 |
�����Ҫ��ش�
��1���������������c________ (ѡ��������������С��������������)0.2�����Һ������Ũ��c(A��)��c(Na��)�Ĵ�С��ϵ��______________________________________��
��2���Ӣ���ʵ����������˵��HA�ĵ���̶�________(ѡ��������������С��������������)NaA��ˮ��̶ȣ��û����Һ������Ũ���ɴ�С��˳����_____________________________��
��3������ʵ�����û����Һ����ˮ�������c(OH��)��____________mol��L��1��д���û����Һ��������ʽ�Ľ��(���������Ƽ���)��c(Na��)��c(A��)��________mol��L��1�� c(OH��)��c(HA)��________mol��L��1��
����Ŀ�������ü�������NO2��Ⱦ�����о���CH4+2NO2 ![]() N2+CO2+2H2O����1L�ܱ������У����Ʋ�ͬ�¶ȣ��ֱ����0.50molCH4��1.2molNO2�����n(CH4)��ʱ��仯���й�ʵ�����ݼ��±���
N2+CO2+2H2O����1L�ܱ������У����Ʋ�ͬ�¶ȣ��ֱ����0.50molCH4��1.2molNO2�����n(CH4)��ʱ��仯���й�ʵ�����ݼ��±���
��� | �¶� | ʱ��/min n/mol | 0 | 10 | 20 | 40 | 50 |
�� | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
�� | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | �� | 0.15 |
����˵����ȷ����
A. �����У�0~20min�ڣ�NO2�Ľ�������Ϊ0.0125 mol��L-1��min-1
B. ��ʵ�����ݿ�֪ʵ����Ƶ��¶�T12
C. 40minʱ��������T2Ӧ�������Ϊ0.18
D. 0��10min�ڣ�CH4�Ľ������ʢ�>��
����Ŀ��������Ԫ��X��Y��Z��W�����ڱ��е����λ����ͼ��ʾ������WԪ�ص�ԭ�ӽṹʾ��ͼΪ![]() ��
��
W | X | Y |
Z |
��ش��������⣺
��1��ZԪ����Ԫ�����ڱ��е�λ����___________��
��2��X��Y��Z����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳��Ϊ___________��Ԫ�ط��ű�ʾ����
��3��X��Z��W����Ԫ�ص�����������Ӧˮ�����������ǿ����___________���û�ѧʽ��ʾ����
��4���õ���ʽ��ʾWY2���γɹ��̣�___________��
��5��д��W������Ũ���ᷴӦ�Ļ�ѧ����ʽ��___________��
