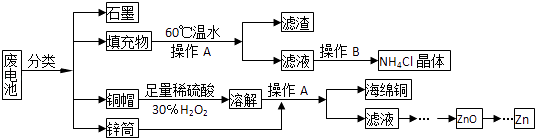
题目内容
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量 浓度(mol·L-1) | NaOH物质的量 浓度(mol·L-1) | 混合溶 液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请根据要求回答:
(1)②组情况表明,c________ (选填“大于”、“小于”或“等于”)0.2。混合液中离子浓度c(A-)与c(Na+)的大小关系是______________________________________。
(2)从③组实验结果分析,说明HA的电离程度________(选填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是_____________________________。
(3)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。写出该混合溶液中下列算式的结果(不能作近似计算)。c(Na+)-c(A-)=________mol·L-1; c(OH-)-c(HA)=________mol·L-1。
【答案】 大于 c(A-)=c(Na+) 大于 c(A-)>c(Na+)>c(H+)>c(OH-) 105 105-109 109
【解析】(1)常温下,一元酸HA和NaOH溶液等体积混合,由①可知:两种溶液的物质的量浓度都为0.1mol/L,则酸碱的物质的量相等,反应后pH=9,说明反应后溶液呈碱性,则HA是弱酸,②中两溶液的等体积混合pH=7(),说明溶液呈中性,故②组中c大于0.2,根据电荷守恒c(A-)+c(OH-)=c(Na+)+ c(H+),溶液呈中性,即c(OH-)=c(H+),可得c(A-)=c(Na+);(2)③组反应后溶液中含有等物质的量的HA、NaA,因反应后溶液的pH<7,溶液呈酸性,说明HA的电离程度大于NaA的水解程度,故混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-);(3)①组溶液的pH=9,则氢离子浓度为10-9mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=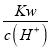 =
=![]() =10-5mol/L,一元酸HA和NaOH溶液等体积混合生成NaA溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),依据上述计算得到:c(Na+)-c(A-)=c(OH-)-c(H+)=10-5-10-9;依据溶液中电荷守恒和物料守恒得到:c(Na+)+c(H+)=c(OH-)+c(A-),c(Na+)=c(A-)+c(HA),合并得到c(OH-)-c(HA)=c(H+)=10-9。
=10-5mol/L,一元酸HA和NaOH溶液等体积混合生成NaA溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),依据上述计算得到:c(Na+)-c(A-)=c(OH-)-c(H+)=10-5-10-9;依据溶液中电荷守恒和物料守恒得到:c(Na+)+c(H+)=c(OH-)+c(A-),c(Na+)=c(A-)+c(HA),合并得到c(OH-)-c(HA)=c(H+)=10-9。

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
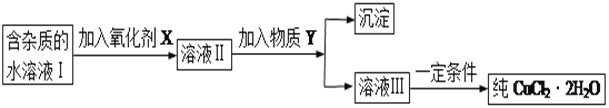
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)