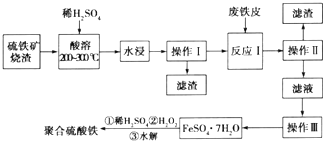
题目内容
16.近年来,由于二氧化碳的大量排放,直接威胁着人类赖于生存的生态环境.人们愈来愈关注着二氧化碳气体的开发及利用.(1)据报道,美国海军科学家拟从海水中提取H2,从空气中提取CO2合成短链羟来代替汽油.已知氢气的燃烧热为-285.8kJ•mol-1;辛烷(C8H18,可作为汽油用)的燃烧热为-5518kJ•mol-1.写出CO2和H2合成辛烷的热化成方程式8CO2(g)+25H2(g)=C8H18(l)+16H2O(l)△H=-1627 k J•mol-1.
(2)二氧化碳加氢合成甲醇是其合理利用碳资源的有效途径之一,反应如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,下列能确定该条件下反应达到最大转化限度的是AB.
A、CO2含量不再变化 B、容器内压强不再变化
C、3v正(H2)=v逆(CH3OH) D、△H不再发生变化
②同时测得不同时刻的反应前后压强关系如下:
| 时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/P前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
列式计算该温度下CO2的平衡转化率:40%.
③若反应条件为压强6MPa,300℃的反应温度下二氧化碳和氢气按1:3的比例通入,测得二氧化碳的平衡转化率℃为50%,该反应该条件的平衡常数KP=$\frac{1}{27}$(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);列举提高CO2转化率的措施增大氢气与CO2的比例或及时分离出甲醇或水蒸气.
(3)CO2和NaOH溶液反应可生成NaHCO3溶液,查阅资料得常温下H2CO3的电离平衡常数K1=4.2×10-7,K2=5.6×10-11;实验测得常温下0.1mol/L的NaHCO3的pH为8,则0.1mol/L的NaHCO3溶液中离子浓度大小顺序为A.
A、c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+)
B、c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C、c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
D、c(Na+)>c(OH-)>c(HCO3-)>c(H+)>c(CO32-)
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,据此计算25mol氢气完全燃烧放出热量,标注物质聚集状态和对应反应的焓变写出热化学方程式;
(2)①该条件下反应达到最大转化限度是指反应达到平衡状态,正逆反应速率相同,个组分含量保持不变,据此分析选项
②反应速率V=$\frac{△c}{△t}$计算得到,反应物转化率=$\frac{消耗量}{起始量}$×100%;
③依据三段式列式计算平衡时气体物质的量,压强之比等于气体物质的量之比,计算得到各气体的分压,结合平衡常数概念计算,提高CO2转化率可以增加氢气的量,也可以改变条件使平衡正向进行;
(3)实验测得常温下0.1mol/L的NaHCO3的pH为8,溶液显碱性,碳酸氢根离子水解大于其电离程度;
解答 解:(1)已知氢气的燃烧热为-285.8kJ•mol-1;辛烷(C8H18,可作为汽油用)的燃烧热为-5518kJ•mol-1.25mol氢气完全燃烧放热1627 k J,写出CO2和H2合成辛烷的热化成方程式8CO2(g)+25H2(g)=C8H18(l)+16H2O(l)△H=-1627 k J•mol-1,
故答案为:8CO2(g)+25H2(g)=C8H18(l)+16H2O(l)△H=-1627 k J•mol-1;
(2)①该条件下反应达到最大转化限度是指反应达到平衡状态,
将1molCO2和3molH2充入体积不变的2L密闭容器中发生反应,CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反应是气体体积减小的反应
A、CO2含量不再变化,说明反应达到平衡状态,故A正确;
B、容器内压强不再变化,说明反应达到平衡状态,故B正确;
C、反应速率之比等于化学方程式计量数之比,V正(H2)=3V逆(CH3OH),说明达到平衡状态,但 3v正(H2)=v逆(CH3OH)不能说明正逆反应速率相同,故C错误;
D、反应焓变和物质聚集状态及物质的量有关,确定的化学反应,焓变不变,△H不再发生变化不能说明反应达到平衡状态,故D错误;
故答案为:AB;
②设反应的二氧化碳物质的量为x,气体压强之比等于气体物质的量之比,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) x 3x x x
平衡量(mol)1-x 3-3x x x
P后:P前=0.85=(4-2x):(1+3)
x=0.3mol
则用氢气表示前2小时反应平均速率V(H2)=$\frac{\frac{3×0.3mol}{2L}}{2h}$=0.225mol/(L•h),
反应达到平衡状态时,二氧化碳反应物质的量为y,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol)y 3y y y
平衡量(mol)1-y 3-3y y y
P后:P前=0.8=(4-2y):(1+3)
y=0.4mol
该温度下CO2的平衡转化率=$\frac{0.4mol}{1mol}$×100%=40%,
故答案为:0.225mol/(L•h);40%;
③若反应条件为压强6MPa,300℃的反应温度下二氧化碳和氢气按1:3的比例通入,测得二氧化碳的平衡转化率℃为50%,结合三段式列式计算,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.5 1.5 0.5 0.5
平衡量(mol) 0.5 1.5 0.5 0.5
分压=总压×物质的量分数
P(CO2)=6×$\frac{0.5}{3}$=1
P(H2)=6×$\frac{1.5}{3}$=3
P(CH3OH)=6×$\frac{0.5}{3}$=1
P(H2O)=6×$\frac{0.5}{3}$=1
Kp=$\frac{1}{1×{3}^{3}}$=$\frac{1}{27}$(MPa)-2
提高CO2转化率可以增加氢气的量,也可以改变条件使平衡正向进行;采取的措施是增大氢气与CO2的比例或及时分离出甲醇或水蒸气,提高CO2转化率,
故答案为:$\frac{1}{27}$(MPa)-2,增大氢气与CO2的比例或及时分离出甲醇或水蒸气;
(3)实验测得常温下0.1mol/L的NaHCO3的pH为8,溶液显碱性,碳酸氢根离子水解大于其电离程度,溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故选A,
故答案为:A.
点评 本题考查了化学反应速率、平衡三段式和平衡常数概念的计算应用,影响平衡影响分析判断,盐类水解实质理解,掌握基础是关键,题目难度中等.

 考前必练系列答案
考前必练系列答案| A. | 饱和石灰水加入生石灰,若温度不变,则溶液中Ca2+的物质的量不变 | |
| B. | 饱和石灰水加入生石灰,若温度不变,则pH不变 | |
| C. | 升高饱和石灰水的温度时,Ca(OH)2的溶度积常数Ksp不变 | |
| D. | 石灰水显碱性,能使蛋白质变性,所以有防治树木害虫病的作用 |
| A. | 过氧化钠、纯碱分别属于碱性氧化物、碱 | |
| B. | NO、NO2 都是大气污染物,在空气中都能稳定存在 | |
| C. | SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物 | |
| D. | 检验某浅绿色溶液中含有Fe2+:取该溶液少许,向其中加入KSCN溶液,不变红色,再向其中滴加氯水,溶液变为红色 |
| A. | 用激光笔分别照射盛有牛奶、食盐水的玻璃杯,都有光亮的通路 | |
| B. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,转换材料是二氧化硅 | |
| C. | 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 | |
| D. | 可以用物理方法或化学方法从海水中提取所需物质 |
| A. | 仅②④⑤ | B. | 仅①③④ | C. | 仅①②③④ | D. | ①②③④⑤ |
 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2.
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2. .
.