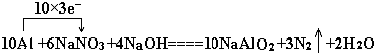题目内容
5.某有机物的结构简式为CH3-CH=CH-COOH.现有①铁;②溴的四氯化碳溶液;③碳酸氢钠溶液;④丙醇;⑤酸性高锰酸钾溶液,判断在一定条件下,能与该有机物反应的物质是( )| A. | 仅②④⑤ | B. | 仅①③④ | C. | 仅①②③④ | D. | ①②③④⑤ |
分析 CH3-CH=CH-COOH中含碳碳双键、-COOH,结合烯烃、羧酸的性质来解答.
解答 解:含-COOH,与①铁、③碳酸氢钠溶液、④丙醇发生反应,分别为置换反应、复分解反应、酯化反应;
含碳碳双键,与②溴的四氯化碳溶液、⑤酸性高锰酸钾溶液反应,分别为加成反应、氧化反应,
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、羧酸的性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
16.近年来,由于二氧化碳的大量排放,直接威胁着人类赖于生存的生态环境.人们愈来愈关注着二氧化碳气体的开发及利用.
(1)据报道,美国海军科学家拟从海水中提取H2,从空气中提取CO2合成短链羟来代替汽油.已知氢气的燃烧热为-285.8kJ•mol-1;辛烷(C8H18,可作为汽油用)的燃烧热为-5518kJ•mol-1.写出CO2和H2合成辛烷的热化成方程式8CO2(g)+25H2(g)=C8H18(l)+16H2O(l)△H=-1627 k J•mol-1.
(2)二氧化碳加氢合成甲醇是其合理利用碳资源的有效途径之一,反应如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,下列能确定该条件下反应达到最大转化限度的是AB.
A、CO2含量不再变化 B、容器内压强不再变化
C、3v正(H2)=v逆(CH3OH) D、△H不再发生变化
②同时测得不同时刻的反应前后压强关系如下:
则用氢气表示前2小时反应平均速率V(H2)=0.225mol/(L•h).
列式计算该温度下CO2的平衡转化率:40%.
③若反应条件为压强6MPa,300℃的反应温度下二氧化碳和氢气按1:3的比例通入,测得二氧化碳的平衡转化率℃为50%,该反应该条件的平衡常数KP=$\frac{1}{27}$(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);列举提高CO2转化率的措施增大氢气与CO2的比例或及时分离出甲醇或水蒸气.
(3)CO2和NaOH溶液反应可生成NaHCO3溶液,查阅资料得常温下H2CO3的电离平衡常数K1=4.2×10-7,K2=5.6×10-11;实验测得常温下0.1mol/L的NaHCO3的pH为8,则0.1mol/L的NaHCO3溶液中离子浓度大小顺序为A.
A、c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+)
B、c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C、c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
D、c(Na+)>c(OH-)>c(HCO3-)>c(H+)>c(CO32-)
(1)据报道,美国海军科学家拟从海水中提取H2,从空气中提取CO2合成短链羟来代替汽油.已知氢气的燃烧热为-285.8kJ•mol-1;辛烷(C8H18,可作为汽油用)的燃烧热为-5518kJ•mol-1.写出CO2和H2合成辛烷的热化成方程式8CO2(g)+25H2(g)=C8H18(l)+16H2O(l)△H=-1627 k J•mol-1.
(2)二氧化碳加氢合成甲醇是其合理利用碳资源的有效途径之一,反应如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,下列能确定该条件下反应达到最大转化限度的是AB.
A、CO2含量不再变化 B、容器内压强不再变化
C、3v正(H2)=v逆(CH3OH) D、△H不再发生变化
②同时测得不同时刻的反应前后压强关系如下:
| 时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/P前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
列式计算该温度下CO2的平衡转化率:40%.
③若反应条件为压强6MPa,300℃的反应温度下二氧化碳和氢气按1:3的比例通入,测得二氧化碳的平衡转化率℃为50%,该反应该条件的平衡常数KP=$\frac{1}{27}$(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);列举提高CO2转化率的措施增大氢气与CO2的比例或及时分离出甲醇或水蒸气.
(3)CO2和NaOH溶液反应可生成NaHCO3溶液,查阅资料得常温下H2CO3的电离平衡常数K1=4.2×10-7,K2=5.6×10-11;实验测得常温下0.1mol/L的NaHCO3的pH为8,则0.1mol/L的NaHCO3溶液中离子浓度大小顺序为A.
A、c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+)
B、c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C、c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
D、c(Na+)>c(OH-)>c(HCO3-)>c(H+)>c(CO32-)
20.海水中蕴藏着丰富的资源.海水综合利用的流程图如图.
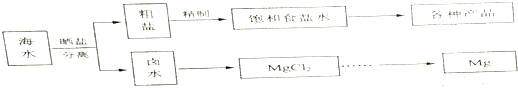
(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL所体(标准状况),则所得溶液的pH为13(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑.
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.
①粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去.Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表).若只加一种上述(1)中得到的产品,该物质的化学式为NaClO,控制溶液的pH为9.6≤PH<9.8.
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:O2+4e-+2H2O═4OH-.

(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL所体(标准状况),则所得溶液的pH为13(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑.
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.
①粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去.Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表).若只加一种上述(1)中得到的产品,该物质的化学式为NaClO,控制溶液的pH为9.6≤PH<9.8.
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:O2+4e-+2H2O═4OH-.
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.6 |
| Mg(OH)2 | 9.8 | 11.1 |
14.一个实验桌上放着四瓶化学药品,标签上分别写着蔗糖、淀粉、氯化钠、食用味精.为研究这些物质的性质,下列说法中不可取的是( )
| A. | 观察比较外观形态 | B. | 用手触摸比较 | ||
| C. | 放到嘴里品尝一下 | D. | 用化学方法进行鉴别 |
12.下列有关有机物的说法中正确的是( )
| A. | 凡是含碳元素的化合物都属于有机物 | |
| B. | 易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 | |
| C. | 所有的有机物都很容易燃烧 | |
| D. | 有机物所发生的反应,一般比较复杂,速度缓慢,并且还常伴有副反应发生 |
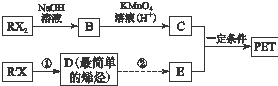 PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%.
PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%. .
.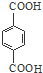 +nHOCH2CH2OH$\stackrel{一定条件下}{→}$
+nHOCH2CH2OH$\stackrel{一定条件下}{→}$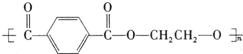 +2nH2O.
+2nH2O.