题目内容
【题目】硫酸的年产量可以用来衡量一个国家的化工生产能力.工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)2SO3(g).反应体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
(1)画出硫原子的结构示意图
(2)下列说法正确的是a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.在D点时,v正>v逆
c.B点、C点反应的平衡常数分别为K1、K2 , 则K1<K2
d.在A点时,消耗1mol SO2必定同时消耗1mol SO3 .
【答案】
(1)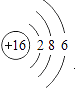
(2)bd
【解析】解:(1)在原子结构示意图中,圆圈表示原子核,圆圈内的数值为质子数,核外电子层用弧线表示,弧线上的数据表示每层的电子数.硫原子的质子数是16,原子结构示意图为: 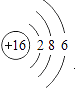 ,所以答案是:
,所以答案是: 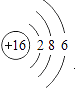 .(2)a、恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动,故错误; b、D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行建立平衡,所以V正>V逆 , 故正确; c、由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,K值减小,故平衡常数K1>K2 , 故错误; d、在A点为平衡点,正逆反应速率相等,所以消耗1mol SO2必定同时消耗1mol SO3 , 故正确;故选:bd.
.(2)a、恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动,故错误; b、D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行建立平衡,所以V正>V逆 , 故正确; c、由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,K值减小,故平衡常数K1>K2 , 故错误; d、在A点为平衡点,正逆反应速率相等,所以消耗1mol SO2必定同时消耗1mol SO3 , 故正确;故选:bd.

【题目】甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)HCOOH(l)+CH3OH(l)△H>0某温度下,V L混合体系中各组分的起始量如下表,HCOOCH3转化率随反应时间t的变化如图(假设混合体系体积不变).下列说法正确的是( )
组分 | 物质的量/mol |
HCOOCH3 | 1.00 |
H2O | 1.99 |
HCOOH | 0.01 |
CH3OH | 0.52 |
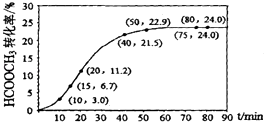
A.温度升髙,该反应的平衡常数减小
B.010min,HCOOCH3的平均反应速率v=0.003molL﹣1min﹣1
C.HCOOCH3水解平均反应速率先是增大,后减小,最后保持不变
D.该条件下达到平衡状态,反应物转化率相等