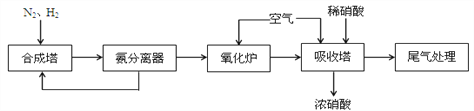
题目内容
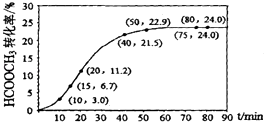
【题目】甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)HCOOH(l)+CH3OH(l)△H>0某温度下,V L混合体系中各组分的起始量如下表,HCOOCH3转化率随反应时间t的变化如图(假设混合体系体积不变).下列说法正确的是( )
组分 | 物质的量/mol |
HCOOCH3 | 1.00 |
H2O | 1.99 |
HCOOH | 0.01 |
CH3OH | 0.52 |
A.温度升髙,该反应的平衡常数减小
B.010min,HCOOCH3的平均反应速率v=0.003molL﹣1min﹣1
C.HCOOCH3水解平均反应速率先是增大,后减小,最后保持不变
D.该条件下达到平衡状态,反应物转化率相等
【答案】C
【解析】解:A.正反应为吸热反应,升高温度平衡向正反应方向移动,则平衡常数增大,故A错误;
B.10min时甲酸甲酯的转化率为3%,参加反应的甲酸甲酯为0.03mol,则v(HCOOCH3)= ![]() =
= ![]() mol/(L.min),故B错误;
mol/(L.min),故B错误;
C.由图可知,相同时间内甲酸甲酯的转化率变化量,先是增大,后减小,最后保持不变,则水解平均反应速率先是增大,后减小,最后保持不变,故C错误;
D.甲酸甲酯与水按物质的量1:1反应,若二者起始物质的量为1:1,则二者转化率相等,而二者起始物质的量为1:1.99,则二者转化率不相等,甲酸甲酯的转化率大于水的转化率,故D错误,
故选:C.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
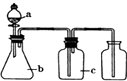
【题目】下表中a、b、c表示相应仪器中加人的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
A.A
B.B
C.C
D.D