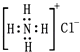题目内容
【题目】标准状况下,将aLH2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b molNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl﹣、ClO﹣、ClO3﹣ , 且三者物质的量之比为8:1:1,则原混合气体中H2的物质的量( )
A.![]()
B.![]() mol
mol
C.( ![]() ﹣
﹣ ![]() )mol
)mol
D.![]() mol
mol
【答案】C
【解析】解:混合气体通入含bmolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl﹣、ClO﹣、ClO﹣3 , 根据电荷守恒可知,溶液中n(Na+)=n(Cl﹣)+n(ClO﹣)+n(ClO3﹣),根据氯元素守恒可知,aLH2和Cl2的混合气体中n(Cl2)= ![]() [n(Cl﹣)+n(ClO﹣)+n(ClO3﹣)]=
[n(Cl﹣)+n(ClO﹣)+n(ClO3﹣)]= ![]() n(Na+)=
n(Na+)= ![]() bmol,所以aLH2和Cl2的混合气体中n(H2)=(
bmol,所以aLH2和Cl2的混合气体中n(H2)=( ![]() ﹣
﹣ ![]() )mol,故选C.
)mol,故选C.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
【题目】实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
选项 | 实验目的 | 试剂X | 试剂Y |
A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |

A.A
B.B
C.C
D.D