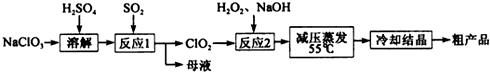
题目内容
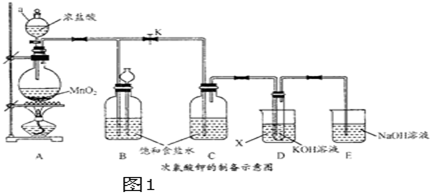
12.氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某化学研究小组利用制取氮化铝,设计图1验装置.试回答:
(1)实验中用饱和NaNO2与NH4Cl溶液制取氮气的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O.
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是c(填写序号).
a.防止NaNO2 饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2 饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好.
(4)化学研究小组的装置存在严重问题,请说明改进的办法在干燥管D末端连接一尾气处理装置.
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气.
①氮化铝和NaOH溶液反应的化学方程式AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑.
②广口瓶中的试剂X最好选用c(填写序号).
a.汽油 b.酒精 c.植物油 d.CCl4
③广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将不变(填“偏大”、“偏小”、“不变”).
④若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积为3.36L(标准状况),则样品中AlN的质量分数为61.5%.
分析 制取氮化铝:用饱和NaNO2与NH4Cl溶液制取氮气NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,装置中分液漏斗与蒸馏烧瓶之间的导管A,平衡内外压强,使NaNO2 饱和溶液容易滴下,制得的氮气排尽装置中的空气,碱石灰干燥氮气,氧化铝、碳和氮气在高温的条件下生成氮化铝和一氧化碳,方程式为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,D防止空气进入反应装置干扰实验.
(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水;
(2)根据实验的需要结合大气压强原理来回答;
(3)只要先将装置密封再利用热胀冷缩原理进行气密性验证;
(4)实验必须对有毒气体进行尾气处理,防止空气污染;
(5)氮化铝和氢氧化钠反应会生成氨气,氨气进入广口瓶后,如果装置密闭,广口瓶中压强会增大,那么就会有水通过广口瓶的长管进入量筒中,根据等量法可知,进入到广口瓶中水的体积就等于生成的氨气的体积.所以通过量筒中排出的水的体积就可以知道氨气的体积,然后有氨气的密度求出氨气的质量,进而根据方程式求出氮化铝的质量.
①AlN跟氢氧化钠溶液反应生成Na[Al(OH)4]、并放出NH3,根据元素守恒可知有水参加反应,据此配平书写反应方程式;
②产生的氨气极易溶于水,为防止氨气溶于水需要把气体与水隔离,因此应选择不能与氨气产生作用的液体作为隔离液;选用的试剂应是和水不互溶,且密度大于水的;
③反应前广口瓶的上方留有的少量空间填充的是空气,反应后广口瓶的上方留有的少量空间填充的是氨气,氨气代替了开始的空气,把最后空间中充入的氨气当成开始时的空气即可;
④根据氨气的体积计算出物质的量,得出其中氮原子的物质的量,根据氮原子守恒,来计算氮化铝的百分含量.
解答 解:制取氮化铝:用饱和NaNO2与NH4Cl溶液制取氮气NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,装置中分液漏斗与蒸馏烧瓶之间的导管A,平衡内外压强,使NaNO2 饱和溶液容易滴下,制得的氮气排尽装置中的空气,碱石灰干燥氮气,氧化铝、碳和氮气在高温的条件下生成氮化铝和一氧化碳,方程式为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,D防止空气进入反应装置干扰实验.
(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水,反应为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,故答案为:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O;
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A具有平衡气压的作用,这样可以保证NaNO2饱和溶液容易滴下,故选c;
(3)关闭分液漏斗开关,使装置处于密闭体系,将导管一端浸入水中,用手紧握锥形瓶外壁,由于热胀冷缩,锥形瓶内气体受热膨胀,如果导管口有气泡冒出,说明气密性良好,否则装置漏气,
故答案为:在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,证明气密性良好;
(4)实验必须对有毒气体进行尾气处理,应在干燥管D末端连接一个尾气处理装置,防止空气污染,
故答案为:在干燥管D末端连接一个尾气处理装置;
(5)①AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,根据元素守恒可知有水参加反应,其反应方程式为:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑,
故答案为:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑
②酒精、汽油虽然都不能与氨气发生反应,但它们却都极易挥发,挥发出来的气体对实验有影响而且挥发完后不能再起到隔离氨气与水接触的作用;同时由于酒精易溶于水,也不能达到隔离的目的;CCl4密度大于水,不能起到隔离作用,而植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离;
故答案为:C;
③本次实验的目的在于测定产生气体的体积而不是收集纯净的气体,因此,把最后空间中充入的氨气当成开始时的空气即可,不会对测量结果产生影响,
故答案为:不变;
④氨气的体积为3.36L(标准状况),物质的量是0.15mol,所以氮化铝的物质的量是0.15mol,质量是0.15mol×41g/mol=6.15g,所以氮化铝的质量分数为
$\frac{6.15}{10}$×100%=61.5%,
故答案为:61.5%.
点评 本题考查对实验原理的理解与实验操作评价、物质含量测定、化学计算等,题目难度中等,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识.

①0.1mol CO;
②9.8g H2SO4;
③1g H2O;
④1.6g O2.
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
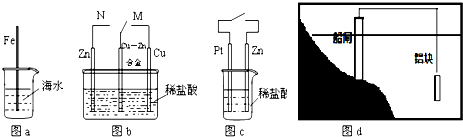
| A. | 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | |
| C. | 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 图d中,船闸采用的是牺牲阴极的阳极保护法 |
| A. | 氯气 | B. | 酒精 | C. | 氯化钠 | D. | 蔗糖 |