��Ŀ����
11�������������Ϊ5L�ĺ����ܱ�������ͨ��2mol A�����1 mol B���壬�������·�Ӧ��2A��g��+B��g��?xC��g����2minʱ��Ӧ�ﵽƽ��״̬����ʱA��ת���ʺ�C�������������25%���ҷų�Q kJ��������������пհף���1������˵��������Ϊ�ÿ��淴Ӧ�ﵽƽ��ı�־����BD��
A���������ƽ����Է�����������һ��
B����λʱ����ÿ����2mol A��ͬʱ������1mol B��
C�������������ܶȺ㶨���䣻
D������B�����ʵ������ٷ����仯
��2���ӷ�Ӧ��ʼ��ƽ��״̬������C��ƽ����Ӧ����Ϊ0.075mol/��L•min����x=3��
���� ��1�����ݻ�ѧƽ��״̬��������𣬵���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯������ʱҪע�⣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
��2������v=$\frac{��c}{��t}$����������⣮
��� �⣺2minʱ��Ӧ�ﵽƽ��״̬����ʱA��ת���ʺ�C�������������25%��������Ӧ��
2A��g��+B��g��?xC��g����
��������2mol 1 mol 0
�仯����2mol��25% 0.25mol 0.25xmol
ƽ������1.5mol 0.75mol 0.25xmol
$\frac{0.25xmol}{0.25xmol+1.5mol\\;+0.75mol}$=$\frac{1}{4}$����֮��x=3��
��1��A���������ƽ����Է�������һֱ����һ�����ʴ���
B����λʱ����ÿ����2mol A��ͬʱ��Ч������1molB��ͬʱ����1molB������ȷ��
C�������������ܶ�ʼ�պ㶨���䣬��C����
D������B�����ʵ������ٷ����仯��˵���������ʺ�����������ȣ�����ȷ��
��ѡBD��
��2������v=$\frac{��c}{��t}$=$\frac{\frac{0.75}{5}}{2}$=0.075mol/��L•min����x=3���ʴ�Ϊ��0.075mol/��L•min����3��
���� ���⿼���˻�ѧƽ��״̬���жϣ��ѶȲ���ע���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�����Ϊ0��

 ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�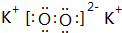 ��
��