题目内容
9.某玻璃厂备有碳酸钙250t,纯碱375t,二氧化硅1200t,计算上述原料能生产普通玻璃多少t?(普通玻璃的成分Na2O:13%.CaO:11.7%,SiO2:75.3%)分析 普通玻璃,其组成为(质量分数):Na2O 13%、CaO 11.7%,SiO2 75.3%,n(Na2O):n(CaO):n(SiO2)=$\frac{13%}{62}$:$\frac{11.7%}{56}$:$\frac{75.3%}{60}$=1:1:6,以氧化物组成的形式表示玻璃的化学式为:Na2O•CaO•6SiO2,由元素守恒可知生成普通玻璃的反应关系为:CaCO3~Na2CO3~6SiO2~Na2O•CaO•6SiO2,进行过量计算,根据不足量的物质计算生成玻璃的质量.
解答 解:普通玻璃,其组成为(质量分数):Na2O 13%、CaO 11.7%,SiO2 75.3%,n(Na2O):n(CaO):n(SiO2)=$\frac{13%}{62}$:$\frac{11.7%}{56}$:$\frac{75.3%}{60}$=1:1:6,以氧化物组成的形式表示玻璃的化学式为:Na2O•CaO•6SiO2,
由元素守恒可知生成普通玻璃的反应关系为:CaCO3~Na2CO3~6SiO2,250tCaCO3完全,需要Na2CO3为250t×$\frac{106}{100}$=265t<375t,需要SiO2的质量为250t×$\frac{360}{100}$=900t<1200t,故CaCO3不足,Na2CO3、SiO2有剩余,由CaCO3~Na2CO3~Na2O•CaO•6SiO2,可知生成普通玻璃为250t×$\frac{62+56+360}{100}$=1195t,
答:能生产普通玻璃1195t.
点评 本题考查化学方程式有关计算,关键是确定普通玻璃的组成,注意利用元素守恒与关系式解答,难度中等.

练习册系列答案
相关题目
17.能正确表示下列反应的离子方程式是( )
| A. | 等体积、等浓度的Ca(HCO3)2 溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O | |
| B. | NH4HCO3 溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 少量SO2通入苯酚钠溶液转:C6H5O-+SO2+H2O═C6H5OH+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2 +2H2O═Al(OH)3 ↓+HCO3- |
4.在Na2SO4和K2SO3混合溶液中,当c(Na+)=0.2mol•L-1,c(SO42-)=x mol•L-1,c(K+)=y mol•L-1时,x与y的关系是( )
| A. | x=y+0.2 | B. | x=$\frac{y}{2}$ | C. | x=0.1+$\frac{y}{2}$ | D. | x=y |
5.氯化亚铜(CuCI)是有机合成工业中应用较广泛的催化剂,微溶于水,不溶于乙醇.工业上以废旧铜为原料生产氯化亚铜的流程如下:
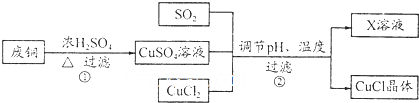
(l)写出过程①的主要化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)分析下表,析出CuCl晶体时的最佳pH为2;当pH较大时,CuCI晶体产率较低,其原因是pH增大,Cu2+水解损失增加.
(3)析出的CuCl晶体不用水而用乙醇洗涤的目的是CuCl不溶于乙醇,微溶于水,可减少晶体损失,且乙醇易挥发,利于干燥.
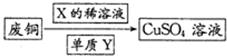
(4)为了更好体现绿色化学思想,有人提出如下方案:方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为O2(填化学式).
方案二:①中Cu与浓H2SO4反应所得SO2和CuSO4用于②中CuCl的制备,理论上不需要(“需要”或“不需要”)另外补充SO2,原因是反应①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中生成的CuSO4和SO2的物质的量之比为1:1,而反应②CuSO4+CuCl2+SO2+2H2O═2Cucl↓+2H2SO4需要的CuSO4和SO2的物质的量之比也恰好为1:1,所以理论上不需要补充SO2(结合化学方程式回答).

(l)写出过程①的主要化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)分析下表,析出CuCl晶体时的最佳pH为2;当pH较大时,CuCI晶体产率较低,其原因是pH增大,Cu2+水解损失增加.
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率(%) | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(4)为了更好体现绿色化学思想,有人提出如下方案:方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为O2(填化学式).

方案二:①中Cu与浓H2SO4反应所得SO2和CuSO4用于②中CuCl的制备,理论上不需要(“需要”或“不需要”)另外补充SO2,原因是反应①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中生成的CuSO4和SO2的物质的量之比为1:1,而反应②CuSO4+CuCl2+SO2+2H2O═2Cucl↓+2H2SO4需要的CuSO4和SO2的物质的量之比也恰好为1:1,所以理论上不需要补充SO2(结合化学方程式回答).
9.已知:
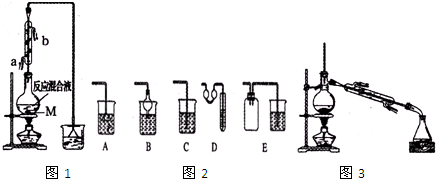
制备1-浪丁烷粗产品在图1装里的圆底烧瓶中依次加人NaBr,lOmL正丁醇.分批加人1,1的硫酸溶液,摇匀,加热30min,发生如下反应:NaBr+H2SO4+CH3CH2CH2OH→CH3CH2CH2Br+NaHSO4+H2O.
(1)反应装置中还需要加人固体M,加人M的目的是防止液体暴沸;.配制体积比为1,1的硫酸所用的玻璃仪器为bcd.a.天平 b.量筒 C.玻璃棒 d.烧杯
(2)冷凝管的进水口是.端,这样选择的原因是能更充分冷凝.
(3)下列图2装置中,能代替图1中最后的收集装里的是B、D、E.
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氛化碳萃取 d.用亚硫酸钠溶液洗涤
(5)制备精品.将得到的粗1一澳丁烷依次用浓硫酸、水、10写碳酸钠、水洗涤后加人无水抓化钙进行干燥,然后再将1-澳丁烷按图3装置燕馏.
①收集产品时,控制的温度应在101.6℃左右,区分1一澳丁烷精品和粗品的一种方法是测熔沸点.
②实验制得的1一澳丁烷的质量为10.895g,则正丁醇的转化率为72.6%.(保留3位小数)
| 药品名称 | 熔点/℃ | 沸点/℃ | 密度g/cm3 | 溶解性 |
| 正丁醇 (CH3CH2CH2OH) | -89.5 | 117.7 | 0.8098 | 微溶于水,溶于浓硫酸 |
| l-溴丁烷 (CH3CH2CH2CH2Br) | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
(1)反应装置中还需要加人固体M,加人M的目的是防止液体暴沸;.配制体积比为1,1的硫酸所用的玻璃仪器为bcd.a.天平 b.量筒 C.玻璃棒 d.烧杯
(2)冷凝管的进水口是.端,这样选择的原因是能更充分冷凝.
(3)下列图2装置中,能代替图1中最后的收集装里的是B、D、E.
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氛化碳萃取 d.用亚硫酸钠溶液洗涤
(5)制备精品.将得到的粗1一澳丁烷依次用浓硫酸、水、10写碳酸钠、水洗涤后加人无水抓化钙进行干燥,然后再将1-澳丁烷按图3装置燕馏.
①收集产品时,控制的温度应在101.6℃左右,区分1一澳丁烷精品和粗品的一种方法是测熔沸点.
②实验制得的1一澳丁烷的质量为10.895g,则正丁醇的转化率为72.6%.(保留3位小数)

10.化学知识在生产和生活中有着重要的应用,下列说法中不正确的是( )
| A. | 大力推广使用太阳能、风能等清洁能源,能减少PM2.5的污染 | |
| B. | 将燃煤通过气化和液化等物理变化可以减少污染,提高燃烧效率 | |
| C. | 发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔 | |
| D. | 金属钠、镁等活泼金属着火时,不能使用泡沫灭火器来灭火 |
