题目内容
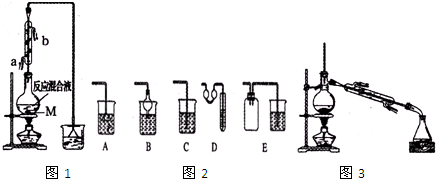
17.高铁酸钾(K2FeO4)是一种高教净水剂.某实验小组用下列两种方法制取(如图1).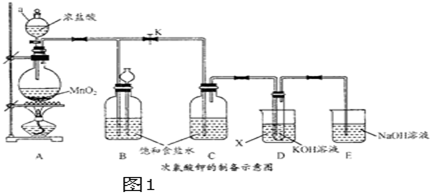
I.次氯酸钾氧化法,已知:Cl2+2KOH$\frac{\underline{\;冷\;}}{\;}$KClO+H2O
3Cl2+6KOH(浓)$\frac{\underline{\;\;△\;\;}}{\;}$5KCl+KClO3+3H2O
(1)a仪器的名称是分液漏斗;物质X是冷水.
(2)开关K可多次关闭,请筒述其中一次的作用关闭K,可以检验装置气密性.
(3)将D中试管取出,依次加入KOH溶液、90%Fe(NO3)3溶液,充分振荡并水浴加热,溶液变紫红色(含K2FeO4).该反应的离子方程式项3ClO-+2Fe3++10 OH-=2FeO42-+3Cl-+5H2O.
Ⅱ.电解法

(1)图2中开始阴极有气体产生,其电极反应式为2H++2e-=H2↑.
(2)开始时阳极有紫红色物质生成,一段时间后阳极变细,紫红色消失,出现红褐色沉淀.针对紫红色消失的原因:甲小组做了如图3所示实验:则该小组提出的假设可能是阳极产生的Fe2+离子将K2FeO4还原.乙小组认为,可能是随着c(H+)增加,K2FeO4发生自身氧化还原反应.为验证该假设,请尝试从控制变量的角度设计实验简案.
(可用试剂:1mo1/L K2FeO4溶液、1mol/L,H2SO4、溶液、4mol/L H2SO4溶液、1 mo1/L KOH溶液8mol/L KOH溶液)
实验的主要步骤:分别取试管加入等体积的1mo1/L K2FeO4溶液,分别滴加等体积的1mol/LH2SO4溶液、4mol/L H2SO4溶液、1 mo1/L KOH溶液、8mol/L KOH溶液;
需要记录的现象及数据:加入酸是否产生气泡,溶液紫色是否褪去,紫红色褪去时间.
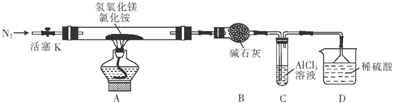
分析 I.装置A中产生氯气,通过控制开关K,反应完毕用装置B收集氯气,防止污染空气,也可以检验装置气密性,可以控制氯气流速,装置C吸收氯气中的HCl,D中发生氯气与氢氧化钾溶液反应生成KClO,应用水进行冷却,E吸收氯气,防止污染空气;
(1)由仪器结构可知,仪器a为分液漏斗;物质X其冷凝作用,可以为冷水;
(2)开始关闭K,可以检验装置气密性;
(3)由题意可知,KClO、KOH、Fe(NO3)3混合水浴加热反应生成K2FeO4,则Cl元素发生还原反应生成KCl,同时生成水;
Ⅱ.(1)阴极发生还原反应,氢离子放电生成氢气;
(2)开始阳极有紫红色物质生成,有K2FeO4生成,一段时间后阳极变细,紫红色消失,出现红褐色沉淀,说明生成氢氧化铁,甲小组中KSCN检验铁离子,可能亚铁离子将K2FeO4还原;
采用控制变量法进行实验,验证随着c(H+)增加K2FeO4发生自身氧化还原反应,应控制K2FeO4的浓度相等,分别加入等体积不同浓度的硫酸、KOH溶液,加入酸可能会有氧气生成,溶液颜色会褪去,且浓度不同反应速率不同,褪色时间不同.
解答 解:I.装置A中产生氯气,通过控制开关K,反应完毕用装置B收集氯气,防止污染空气,也可以检验装置气密性,可以控制氯气流速,装置C吸收氯气中的HCl,D中发生氯气与氢氧化钾溶液反应生成KClO,应用水进行冷却,E吸收氯气,防止污染空气;
(1)由仪器结构可知,仪器a为分液漏斗;物质X其冷凝作用,可以为冷水,
故答案为:分液漏斗;冷水;
(2)开始关闭K,可以检验装置气密性,
故答案为:关闭K,可以检验装置气密性;
(3)由题意可知,KClO、KOH、Fe(NO3)3混合水浴加热反应生成K2FeO4,则Cl元素发生还原反应生成KCl,同时生成水,反应离子方程式为:3ClO-+2Fe3++10 OH-=2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+2Fe3++10 OH-=2FeO42-+3Cl-+5H2O;
Ⅱ.(1)阴极发生还原反应,氢离子放电生成氢气,阴极电极反应式为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(2)开始阳极有紫红色物质生成,有K2FeO4生成,一段时间后阳极变细,紫红色消失,出现红褐色沉淀,说明生成氢氧化铁,甲小组中FeSO4溶液与K2FeO4溶液混合,用KSCN检验铁离子,提出的假设可能是:阳极产生的Fe2+离子将K2FeO4还原;
采用控制变量法进行实验,验证随着c(H+)增加K2FeO4发生自身氧化还原反应,应控制K2FeO4的浓度相等,具体实验步骤为:分别取试管加入等体积的1mo1/L K2FeO4溶液,分别滴加等体积的1mol/LH2SO4溶液、4mol/L H2SO4溶液、1 mo1/L KOH溶液、8mol/L KOH溶液,需要记录的现象与数据为:加入硫酸是否产生气泡,溶液紫色是否褪去,紫红色褪去时间等,
故答案为:阳极产生的Fe2+离子将K2FeO4还原;
分别取试管加入等体积的1mo1/L K2FeO4溶液,分别滴加等体积的1mol/LH2SO4溶液、4mol/L H2SO4溶液、1 mo1/L KOH溶液、8mol/L KOH溶液;
加入硫酸是否产生气泡,溶液紫色是否褪去,紫红色褪去时间.
点评 本题考查物质制备实验、实验方案的分析评价与设计、对装置的分析评价等,是对学生综合能力的考查,难度较大.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案| A. | 等体积、等浓度的Ca(HCO3)2 溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O | |
| B. | NH4HCO3 溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 少量SO2通入苯酚钠溶液转:C6H5O-+SO2+H2O═C6H5OH+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2 +2H2O═Al(OH)3 ↓+HCO3- |
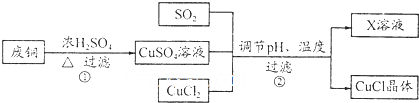
(l)写出过程①的主要化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)分析下表,析出CuCl晶体时的最佳pH为2;当pH较大时,CuCI晶体产率较低,其原因是pH增大,Cu2+水解损失增加.
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率(%) | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(4)为了更好体现绿色化学思想,有人提出如下方案:方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为O2(填化学式).
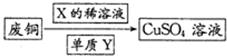
方案二:①中Cu与浓H2SO4反应所得SO2和CuSO4用于②中CuCl的制备,理论上不需要(“需要”或“不需要”)另外补充SO2,原因是反应①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中生成的CuSO4和SO2的物质的量之比为1:1,而反应②CuSO4+CuCl2+SO2+2H2O═2Cucl↓+2H2SO4需要的CuSO4和SO2的物质的量之比也恰好为1:1,所以理论上不需要补充SO2(结合化学方程式回答).
| 药品名称 | 熔点/℃ | 沸点/℃ | 密度g/cm3 | 溶解性 |
| 正丁醇 (CH3CH2CH2OH) | -89.5 | 117.7 | 0.8098 | 微溶于水,溶于浓硫酸 |
| l-溴丁烷 (CH3CH2CH2CH2Br) | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
(1)反应装置中还需要加人固体M,加人M的目的是防止液体暴沸;.配制体积比为1,1的硫酸所用的玻璃仪器为bcd.a.天平 b.量筒 C.玻璃棒 d.烧杯
(2)冷凝管的进水口是.端,这样选择的原因是能更充分冷凝.
(3)下列图2装置中,能代替图1中最后的收集装里的是B、D、E.
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氛化碳萃取 d.用亚硫酸钠溶液洗涤
(5)制备精品.将得到的粗1一澳丁烷依次用浓硫酸、水、10写碳酸钠、水洗涤后加人无水抓化钙进行干燥,然后再将1-澳丁烷按图3装置燕馏.
①收集产品时,控制的温度应在101.6℃左右,区分1一澳丁烷精品和粗品的一种方法是测熔沸点.
②实验制得的1一澳丁烷的质量为10.895g,则正丁醇的转化率为72.6%.(保留3位小数)
| A. | 氢键、极性键、非极性键 | B. | 氢键、氢键、极性键 | ||
| C. | 氢键、氢键、非极性键 | D. | 氢键、非极性键、极性键 |
| A. | =393.28 kJ | B. | =196.64 kJ | C. | <196.64 kJ | D. | >196.64 kJ |
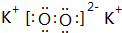 ;
;