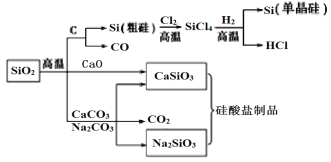
��Ŀ����
����Ŀ����1����֪�����ȼ����Ϊ890.3 kJ��mol��1��д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��__________________________
��2����ͼ��һ���绯ѧ���̵�ʾ��ͼ����ͼ�ش��������⣺
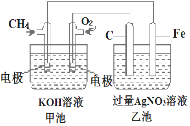
�ټ׳���___________________װ�á�
����ش�缫�����ƣ�Fe�缫�ĵ缫������__________
��д���缫��Ӧʽ��ͨ��CH4�ĵ缫��Ӧʽ��__________________________��Fe�缫�ĵ缫��ӦʽΪ______________________
���ҳ��з�Ӧ�Ļ�ѧ����ʽΪ___________________________�����ҳ���ʯī��C���缫�����ɵ���������ڱ�״����Ϊ112mLʱ��200mL AgNO3��Һ�����ҳ���Һ������仯���Ժ��ԣ���pHֵ=_________
���𰸡�CH4(g)��2O2(g)==CO2(g)��2H2O(l)��H����890.3 kJ��mol��1 ԭ��� ���� CH4��8e����10OH��===CO32��+7H2O Ag����e��=== Ag 4AgNO3��2H2O![]() 4Ag��O2����4HNO3 1
4Ag��O2����4HNO3 1
��������
��1�������ȼ������ָ1mol����������ȼ�շ�Ӧ���ɶ�����̼��Һ̬ˮʱ�ų������������Ա�ʾij����ȼ���ȵ��Ȼ�ѧ����ʽ��ȼ��ǰ���ϵ��������1��
��2���ɵ绯ѧ���̵�ʾ��ͼ��֪���׳���ȼ�ϵ�أ�����ѧ��ת��Ϊ���ܣ�����ԭ��أ�ͨ������һ��Ϊ����������������Ӧ��ͨ��������һ��Ϊ������������ԭ��Ӧ���ҳ�Ϊ�����������Һ�ĵ��أ�C�缫����ԭ���������Ϊ���ص������������Դ������Ϊ���ص�������
��1�������ȼ����Ϊ890.3kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4��g��+2O2��g���T2CO2��g��+2H2O��l����H=-890.3kJmol-1���ʴ�Ϊ��CH4��g��+2O2��g���T2CO2��g��+2H2O��l����H=-890.3kJmol-1��
��2�����ɵ绯ѧ���̵�ʾ��ͼ��֪���׳���ȼ�ϵ�أ�����ѧ��ת��Ϊ���ܣ�����ԭ��أ��ʴ�Ϊ��ԭ��أ�
�������Դ������Ϊ���ص��������ʴ�Ϊ��������
��ͨ�����ĵ缫�Ǹ����������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪCH4+10OH--8e-CO32-+7H2O�������Դ������������������Һ��������������A�õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪAg++e-=Ag���ʴ�Ϊ��CH4+10OH--8e-=CO32-+7H2O��Ag++e-=Ag��
���ҳ�Ϊ�����������Һ�ĵ��أ��ҳ��������������������ŵ硢�������������Ϸŵ磬���ҳص�ط�ӦʽΪ4AgNO3��2H2O![]() 4Ag��O2����4HNO3��������������ʧ���ӷ���������Ӧ����O2����״����112mL O2�����ʵ���Ϊ0.005mol���ɵ�ⷽ��ʽ��֪���������0.02molHNO3����Һ��c��H+��=0.02mol/0.2L=0.1mol/L����pH=1���ʴ�Ϊ��4AgNO3��2H2O
4Ag��O2����4HNO3��������������ʧ���ӷ���������Ӧ����O2����״����112mL O2�����ʵ���Ϊ0.005mol���ɵ�ⷽ��ʽ��֪���������0.02molHNO3����Һ��c��H+��=0.02mol/0.2L=0.1mol/L����pH=1���ʴ�Ϊ��4AgNO3��2H2O![]() 4Ag��O2����4HNO3��1��
4Ag��O2����4HNO3��1��