题目内容
关于离子键、共价键的各种叙述中,下列说法正确的是 ( )
| A.在离子化合物里,只存在离子键,没有共价键 |
| B.非极性键只存在于双原子的单质分子(如Cl2)中 |
| C.在共价化合物分子内,一定不存在离子键 |
| D.由不同元素组成的多原子分子里,一定只存在极性键 |
C
解析试题分析:A.在离子化合物里,一定存在离子键,可能有共价键,错误;B.非极性键可以存在于双原子的单质分子(如Cl2)中。多原子分子若P4、固体非金属单质如金刚石、共价化合物若H2O、离子化合物如NaOH中,错误;C.在共价化合物分子内,一定不存在离子键,正确;D.由不同元素组成的多原子分子里,一定存在极性键,可能存在非极性共价键,错误。
考点:考查共价键的分类及存在的知识。

练习册系列答案
相关题目
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
有 (填序号)。

A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
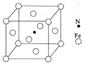
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为
下列原子与氢原子形成的共价键中,极性最强的是
| A.F | B.Cl | C.N | D.O |
下列物质中,既含离子键又含共价键的是
| A.HCl | B.NaOH | C.NaCl | D.O2 |
下列关于σ键和π键的理解不正确的是( )
| A.σ键能单独形成,而π键一定不能单独形成 |
| B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C.HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D.气体单质中一定存在σ键,可能存在π键 |
有关化学键和化合物的叙述不正确的是
| A.盐酸中含有H+和Cl-,所以HCl是离子化合物 |
| B.Na2O2中含有离子键和非极性共价键 |
| C.完全由非金属元素组成的化合物可能是离子化合物 |
| D.双原子或多原子的单质分子中均存在化学键 |
下列关于化学键与化合物的叙述正确的是
①离子化合物中一定含有金属元素 ②共价化合物中一定不含有金属元素 ③离子化合物中一定含有离子键 ④离子化合物中一定不含有共价键 ⑤离子化合物中可能含有共价键 ⑥共价化合物中可能含有离子键 ⑦共价化合物中一定不含有离子键
| A.①⑤⑥⑦ | B.②③④ | C.③⑤⑦ | D.②③⑥⑦ |
下列各组物质的晶体中,化学键类型和晶体类型都相同的是
| A.CO2和H2O | B.NaOH和CH4 |
| C.SiO2和CO2 | D.NaCl和HCl |