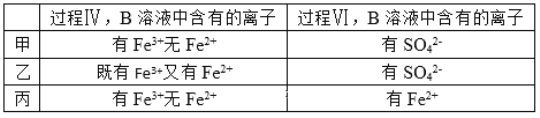
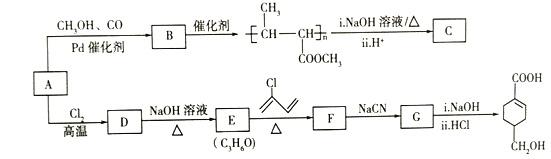
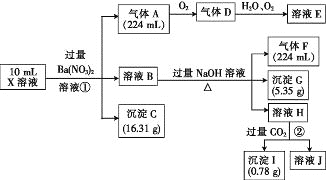
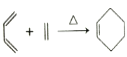题目内容
【题目】芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸 。反应原理:
![]() +2KMnO4
+2KMnO4 ![]() +KOH+2MnO2 +H2O
+KOH+2MnO2 +H2O
![]() +HCl
+HCl![]() +KCl
+KCl
反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:
下图回流搅拌装置
下图抽滤装置

实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
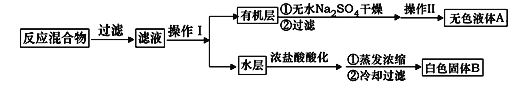
(1)无色液体A的结构简式为___________。操作Ⅱ为__________。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是______。
(3)下列关于仪器的组装或者使用正确的是__________。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入__________,分液,水层再加入__________,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为______________。
【答案】(1)![]() (2分) 蒸馏(2分)
(2分) 蒸馏(2分)
(2)除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气;(2分)
(3)ABD (2分)漏选得一分,错选不得分
(4) NaOH溶液(2分) 浓盐酸酸化(2分) (5) 96% (2分)
【解析】
试题(1)结合操作目的,分析流程知:对反应后的溶液过滤除去生成的MnO2,滤液经分液所得有机层含有末反应的甲苯,水层含有生成的苯甲酸钾及其它可溶性物质。有机层经干燥剂干燥、过滤后,再经操作II得到的无色液体A应为甲苯。操作II为蒸馏。(2) 滤液呈紫色,证明高锰酸钾有剩余,又因为高锰酸钾会与浓盐酸反应产生氯气,所以应先加KHSO4除去末反应的高锰酸钾,再加浓盐酸酸化。(3) A、抽滤可以加快过滤速度,得到较干燥的沉淀;故A正确。
B、安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触;故B正确。C、三颈烧瓶不能直接加热;故C不正确。D冷凝管中水的流向应是下进上出。故D正确。(4) 除去残留在苯甲酸中的甲苯时,先加入NaOH溶液,使苯甲酸转化为可溶性的苯甲酸钠溶于水,再经分液操作,将甲苯(有机层)除去,然后用浓盐酸把可溶性的苯甲酸钠转化为苯甲酸。(5) 根据关系式:
![]() --KOH
--KOH
122g 1mol
m 4×2.4×10-3mol
m=122g×4×2.4×10-3mol /1mol= 1.1712g
产品中苯甲酸质量分数为:1.1712g/1.22g×100%=96%

【题目】雾霾天气严重影响人们的生活和健康。因此采取改善能源结构、机动车限号等措施来减少PM2.5、SO2、NOx等污染。请回答下列问题:
Ⅰ. 臭氧是理想的烟气脱硝剂,其脱硝的反应之一为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生该反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生该反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | 1molO3和2molNO2 | 1molO3和2molNO2 |
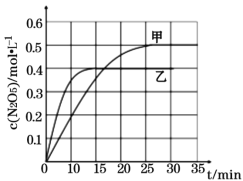
①0~15min内乙容器中反应的平均速率:v(NO2) =____(计算结果保留两位小数)。
②该反应的正反应为____(填“吸热”或“放热”)反应。
③T1时平衡后,向恒容容器中再充入1molO3和2molNO2,再次平衡后,NO2的百分含量将____(填“增大”“减小”或“不变”)。
④反应体系在温度为T1时的平衡常数为____。
⑤在恒温恒容条件下,下列条件不能证明该反应已经达到平衡的是____。
a.容器内混合气体压强不再改变
b.消耗2n molNO2的同时,消耗了n molO3
c.混合气体的平均相对分子质量不再改变
d.混合气体密度不再改变
II. 某化学小组查阅资料后得知:2NO(g)+O2(g) ![]() 2NO2(g) 的反应历程分两步:
2NO2(g) 的反应历程分两步:
①2NO(g)=N2O2(g) (快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)
②N2O2(g)+O2(g)=2NO2(g) (慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2)
请回答下列问题:
(1)已知决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率的是反应②,则反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
2NO2(g)反应速率的是反应②,则反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
(2)一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=____。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=____。