题目内容
(16分)实验室模拟合成氨和氨催化氧化的流程如下:
(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式 。从下图中选择制取氮气的合适装置 。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 。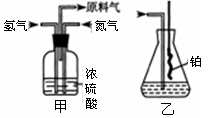
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(4)反应结束后锥形瓶内的溶液中含有H+、OH-、 离子。
(1)NaNO2 + NH4Cl NaCl + N2↑+2H2O a
NaCl + N2↑+2H2O a
(2)干燥气体控制氢气和氮气的流速(3)说明氨的氧化反应是一个放热反应;有红棕色气体产生
(4)NH4+、NO3-
解析试题分析:(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气, 该反应的化学方程式为:NaNO2 + NH4Cl NaCl + N2↑+2H2O。该反应为液+液
NaCl + N2↑+2H2O。该反应为液+液 气体。所以应该选择a装置。(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有控制氢气和氮气的流速,以调节二者的混合比例及对气体进行干燥处理。(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是氨的氧化反应是一个放热反应。氨氧化的方程式为4NH3+5O2
气体。所以应该选择a装置。(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有控制氢气和氮气的流速,以调节二者的混合比例及对气体进行干燥处理。(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是氨的氧化反应是一个放热反应。氨氧化的方程式为4NH3+5O2 4NO+6H2O;产生的NO在锥形瓶上方遇空气发生反应:2NO+ O2= 2NO2产生红棕色的NO2气体。因此锥形瓶中还可观察到的现象是有红棕色气体产生。(4)产生的NO2在水中溶解发生反应3NO2+ H2O == 2HNO3+ NO得到硝酸,硝酸与氨气发生反应得到NH4NO3.因此反应结束后锥形瓶内的溶液中含有H+、OH-、NH4+、NO3-。
4NO+6H2O;产生的NO在锥形瓶上方遇空气发生反应:2NO+ O2= 2NO2产生红棕色的NO2气体。因此锥形瓶中还可观察到的现象是有红棕色气体产生。(4)产生的NO2在水中溶解发生反应3NO2+ H2O == 2HNO3+ NO得到硝酸,硝酸与氨气发生反应得到NH4NO3.因此反应结束后锥形瓶内的溶液中含有H+、OH-、NH4+、NO3-。
考点:考查实验室制取氮气的实验原理、操作及氨气的催化氧化的现象、溶液中含有的成分的确定的知识。

[14分]实验室制备苯乙酮的化学方程式为:
制备过程中还有
 等副反应。
等副反应。
主要实验装置和步骤如下:
(I)合成:在三颈瓶中加入20 g无水AlCl3和30 mL无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6 mL乙酸酐和10 mL无水苯的混合液,控制滴加速率,使反应液缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层
②水层用苯萃取,分液
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮。回答下列问题:
(1)仪器a的名称:____________;装置b的作用:________________________________。
(2)合成过程中要求无水操作,理由是____________________________________________。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致_________________。
| A.反应太剧烈 | B.液体太多搅不动 | C.反应变缓慢 | D.副产物增多 |
(5)分液漏斗使用前须___________________并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并________________后,将分液漏斗置于铁架台的铁卷上静置片刻,分层。分离上下层液体时,应先________________,然后打开活塞放出下层液体,上层液体从上口倒出。(6)粗产品蒸馏提纯时,下来装置中温度计位置正确的是________________,可能会导致收集到的产品中混有低沸点杂质的装置是________________。

S2Cl2是工业上常用的硫化剂,实验室制备的方法有2种: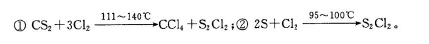 已知在S2Cl2中硫元素显+1价,电子式:
已知在S2Cl2中硫元素显+1价,电子式: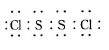 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下: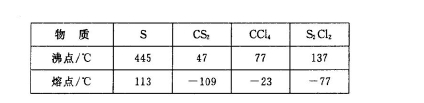
实验室利用下列装置制备 (部分夹持仪器已略去):
回答下列问题:
(1)写出A装置中发生反应的离子方程式
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是
(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置可应用于下列高中化学中 实验。
| A.石油分馏 | B.制备乙烯 | C.制取乙酸乙酯 | D.制取溴苯 |
(5)A装置仪器装配时,整套装置装配完毕后,应先进行 ,再添加试剂。实验完毕,拆除装置时,应先将E中长导管移开液面,目的是
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清,出现该现象的原因可用化学方程式表示为 。实验完毕,当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是 (用离子方程式表示)。


 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:





