题目内容
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中溶液的颜色从_________色变为___________色时,停止滴定。
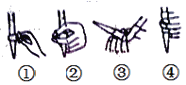
(2)下图中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是_________,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是___________(填“偏高”、“偏低”或“无影响”)
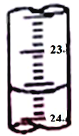
(3)图中是某次滴定时的滴定管中的液面,其读数为__________mL。
(4)根据下列数据:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 24.10 |
第二次 | 20.00 | 3.00 | 27.10 |
请计算待测烧碱溶液的浓度为____________mol/L。
【答案】 黄 橙 ② 偏高 23.60 0.1200
【解析】试题分析:(1)根据滴定终点,锥形瓶中的溶液从黄变为橙色时,且半分钟内不褪色,应停止滴定;
(2)根据酸式滴定管中排气泡的方法回答;如果滴定前有气泡,滴定后气泡消失,则消耗酸的体积偏大;根据c(待测)=![]() 分析;
分析;
(3)根据滴定管的结构与精确度为0.01mL;
(5)先分析所耗盐酸标准液的体积的有效性,然后求出所耗盐酸标准液的体积平均值,然后然后根据关系式HCl~NaOH来解答.
解析:(1)锥形瓶中的溶液从黄变为橙色时,且半分钟内不褪色,应停止滴定;
(2)步骤②用酸式滴定管,酸式滴定管中排气泡的方法:用左手握住旋塞,再排气泡,故②正确;如果滴定前有气泡,滴定后气泡消失,则消耗酸的体积偏大;根据c(待测)=![]() ,对测定结果形成的影响是浓度偏高;
,对测定结果形成的影响是浓度偏高;
(3)根据滴定管的结构与精确度为0.01mL,读数是23.60 mL;
(5)两次平均消耗盐酸的体积为24mL,
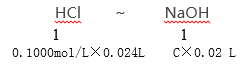
C=![]() 0.1200mol/L。
0.1200mol/L。

【题目】(17分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:_____。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是/span>______,碱性最强的化合物的化学式是:__________。
(3)比较①与⑤的最高价氧化物对应的水化物,_________的酸性强(填化学式);能通过________________________________说明(写反应的化学方程式)。
(4)实验室制取②的氢化物的化学方程式_______________________________ ,②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为______
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________________(用化学方程式表示)
(6)比较③与⑥的氢化物,_________ 更稳定(填化学式)
(7)写出④的单质与水反应的离子方程式_______________________。
(8)写出⑦元素的离子结构示意图______,该离子半径_________ S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置_______________________