题目内容
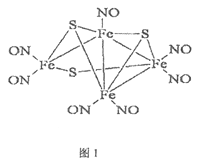
【题目】1985年,Rousssin研究发现了第一个金属原子簇类配位化合物,其结构如图1,金属原子簇类化合物与金属原子表面性质相似,具有良好的催化活性等功能。请回答下列问题:
(1)Fe3+的基态核外价电子排布式为___________。
(2)上述化合物中含有三种非金属元素,试比较三种元素原子第一电离能由大到小顺序为_________;硫可以形成SOCl2化合物,则该化合物的空间构型为__________。
(3)除了氮的氧化物之外,氮还可以形成NO2+。请写出氮原子杂化方式____________。
(4)上述原子簇类配合物,中心原子铁的配位原子是___________。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如下图所示。下列关于Fe(CO)5说法正确的是_________。
A. Fe(CO)5是非极性分子,CO是极性分子
B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C. 1mol Fe(CO)5含有10 mol配位键
D. Fe(CO)5 = Fe+5 CO反应中没有新化学键生成
 。
。
【答案】3d5N>O>S三角锥形spS NAC
【解析】
(1)Fe位于周期表中第4周期第ⅤⅢ族;
(2)化合物中三种非金属元素为N,O,S,同周期主族元素随着原子序数增大,第一电离能呈增大的趋势,但第ⅡA族和第ⅤA族元素反常,根据VSEPR理论判断SOCl2的空间构型;
(3)根据VSEPR理论和杂化轨道理论判断;
(4)直接与中心原子成键的为配位原子;
(5)A、看正负电荷中心是否重叠;B、铁不是正四面构型;C、碳与氧、铁与碳之间形成配位键;D、化学反应的实质是旧键的断裂,新键的生成。
(1)Fe位于周期表中第4周期第ⅤⅢ族,Fe3+的基态核外价电子排布式为3d5 ;
(2)化合物中三种非金属元素为N、O、S,同周期主族元素随着原子序数增大,第一电离能呈增大的趋势,但第ⅡA族和第ⅤA族元素反常,则三种元素原子第一电离能由大到小顺序为:N>O>S,
对于SOCl2,其等电子体为SO32-,二者结构相似,根据VSEPR理论,价电子对数为VP=BP+LP=3+(6-2×3+2)/2=4,则其空间构型为三角锥形;
(3)对于NO2+,根据VSEPR理论,价电子对数为VP=BP+LP=2+(5-2×2-1)/2=2,根据杂化轨道理论,则中心N原子为sp杂化;
(4)直接与中心原子成键的为配位原子,所以中心原子铁的配位原子是:N、S
(5)A、看正负电荷中心是否重叠,Fe(CO)5对称是非极性分子,CO不对称是极性分子,故A正确;B、铁的杂化轨道数为5,铁不是正四面构型,Fe(CO)5中Fe原子不是以sp3杂化方式与CO成键,故B错误;C、碳与氧、铁与碳之间形成配位键,1mol Fe(CO)5含有10 mol配位键,故C正确 ;D、化学反应的实质是旧键的断裂,新键的生成,故D错误。
故选AC。

 名校课堂系列答案
名校课堂系列答案