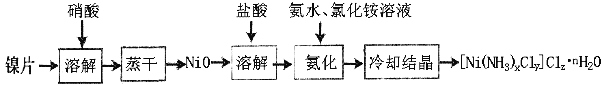
题目内容
【题目】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用![]() 回答下列问题:
回答下列问题:
(1)久存的银制品表面会变黑,失去银白色光泽,原因是 ____________________ .
(2)已知![]() ,若向
,若向![]() 的
的![]() 溶液中加入
溶液中加入![]() 的盐酸,混合后溶液中
的盐酸,混合后溶液中![]() 的浓度为 ______________
的浓度为 ______________ ![]() ,pH为 _______________ .
,pH为 _______________ .
(3)![]() 光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为 _______________________________________ .
光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为 _______________________________________ .
(4)如图所示原电池正极的反应式为________________________________________ .

【答案】 Ag与空气中微量![]() 反应生成黑色的
反应生成黑色的![]()
![]() 2
2 ![]()
![]()
【解析】 Ag与空气中微量![]() 反应生成黑色的
反应生成黑色的![]() 。若向
。若向![]() 的
的![]() 溶液中加入
溶液中加入![]() 的盐酸,两者反应后盐酸剩余,反应后c(Cl-)=0.5
的盐酸,两者反应后盐酸剩余,反应后c(Cl-)=0.5![]() (
(![]() )=
)=![]() ,混合后溶液中
,混合后溶液中![]() 的浓度为
的浓度为![]()
![]() ,盐酸中氢离子不参与离子反应,故两溶液混合后c(H+)=
,盐酸中氢离子不参与离子反应,故两溶液混合后c(H+)=![]() ,pH为2.
,pH为2.![]() 光照易分解,生成Ag和红棕色气体等物质,红棕色气体为二氧化氮,根据化合价的变化规律,可以判断一定有氧气生成。原电池的正极发生还原反应。
光照易分解,生成Ag和红棕色气体等物质,红棕色气体为二氧化氮,根据化合价的变化规律,可以判断一定有氧气生成。原电池的正极发生还原反应。
(1)久存的银制品表面会变黑,失去银白色光泽,原因是Ag与空气中微量![]() 反应生成黑色的
反应生成黑色的![]() .
.
(2)已知![]() ,若向
,若向![]() 的
的![]() 溶液中加入
溶液中加入![]() 的盐酸,两者反应后盐酸剩余,反应后c(Cl-)=0.5
的盐酸,两者反应后盐酸剩余,反应后c(Cl-)=0.5![]() (
(![]() )=
)=![]() ,混合后溶液中
,混合后溶液中![]() 的浓度为
的浓度为![]()
![]() ,盐酸中氢离子不参与离子反应,故两溶液混合后c(H+)=
,盐酸中氢离子不参与离子反应,故两溶液混合后c(H+)=![]() ,pH为2.
,pH为2.
(3)![]() 光照易分解,生成Ag和红棕色气体等物质,红棕色气体为二氧化氮,根据化合价的变化规律,可以判断一定有氧气生成,故其光照分解反应的化学方程式为
光照易分解,生成Ag和红棕色气体等物质,红棕色气体为二氧化氮,根据化合价的变化规律,可以判断一定有氧气生成,故其光照分解反应的化学方程式为 ![]() .
.
(4)由图可知,该原电池的负极为铜、正极为银,正极发生还原反应,其反应式为![]() .
.

 阅读快车系列答案
阅读快车系列答案