题目内容
【题目】研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义,请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,则下列说法正确的是 .
A.若反应速率v(SO2)﹦v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2mol N2 , 化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2mol SO3 , 再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)若某温度下,SO2(g)+ ![]() O2(g)SO3(g)△H=﹣98kJ/mol.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=(用分数表示).在该温度下,分别将0.2mol/L 的SO2 和0.1mol/L O2放入固定体积的密闭容器中,当SO2转化率为60%时,该反应向方向进行
O2(g)SO3(g)△H=﹣98kJ/mol.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=(用分数表示).在该温度下,分别将0.2mol/L 的SO2 和0.1mol/L O2放入固定体积的密闭容器中,当SO2转化率为60%时,该反应向方向进行
(3)在一个2L的密闭容器中充入一定量的SO3发生反应:其中SO3的变化如下图所示:从10 min起,压缩容器为1L,则SO3的变化曲线为(填图象中的字母序号).
(4)反应N2O4(g)2NO2(g);△H=+57kJmol﹣1 , 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是
A.A,C两点的反应速率:A>C
B.A,C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.若P2>P1 , 则化学平衡常数KA>KC
(5)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574KJ/mol
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160KJ/mol
请写出1molCH4还原NO2生成N2、CO2、H2O气态物质的热化学方程式 .
【答案】
(1)DE
(2)![]() ;逆
;逆
(3)c
(4)C
(5)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
【解析】解:(1)A.若反应速率v(SO2)﹦v(SO3),反应方向未知导致无法确定是否达到平衡状态,故A错误;B.保持温度和容器体积不变,充入2mol N2 , 氮气不参加反应,则反应物和生成物浓度不变,平衡不移动,则反应速率不变,故B错误;
C.平衡后仅增大反应物浓度,则平衡一定右移,加入的该物质转化率降低,其它的气体反应物转化率增大,故C错误;
D.平衡后移动活塞压缩气体,平衡正向移动,则反应物含量降低,生成物含量增大,故D正确;
E.保持温度和容器体积不变,平衡后再充入2mol SO3 , 相当于增大压强,平衡正向移动,再次平衡时各组分浓度均比原平衡时的浓度大,故E正确;
F.该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,故F错误;
故选DE;(2)1molSO2完全反应放出98kJ热量,则放出196kJ热量时消耗二氧化硫2mol,消耗氧气1mol,开始时c(SO2)= ![]() =0.04mol/L,c(O2)=
=0.04mol/L,c(O2)= ![]() =0.1mol/L,
=0.1mol/L,
该反应中SO2(g)+ ![]() O2(g)SO3(g)
O2(g)SO3(g)
开始(mol/L)0.04 0.1 0
反应(mol/L)0.02 0.01 0.02
平衡(mol/L)0.02 0.09 0.02
化学平衡常数K= ![]() =
= ![]() =
= ![]() ;
;
在该温度下,分别将0.2mol/L 的SO2 和0.1mol/L O2放入固定体积的密闭容器中,当SO2转化率为60%时,
剩余的c(SO2)=0.2mol/L×(1﹣60%)=0.08mol/L,c(O2)=0.1mol/L﹣0.2mol/L×60%× ![]() =0.04mol/L,生成的c(SO3)=0.2mol/L×60%=0.12mol/L,
=0.04mol/L,生成的c(SO3)=0.2mol/L×60%=0.12mol/L,
浓度商= ![]() =7.5>
=7.5> ![]() ,平衡逆向移动,
,平衡逆向移动,
所以答案是: ![]() ;逆;(3)在一个2L的密闭容器中充入一定量的SO3发生反应:其中SO3的变化如下图所示:从10 min起,压缩容器为1L,容器体积减小导致10min时c(SO3)增大但n(SO3)不变,增大压强平衡正向移动,n(SO3)逐渐增大,所以选c,所以答案是:c;(4)A.A点压强小于C点,压强越大,反应速率越大,所以反应速率A<C,故A错误;
;逆;(3)在一个2L的密闭容器中充入一定量的SO3发生反应:其中SO3的变化如下图所示:从10 min起,压缩容器为1L,容器体积减小导致10min时c(SO3)增大但n(SO3)不变,增大压强平衡正向移动,n(SO3)逐渐增大,所以选c,所以答案是:c;(4)A.A点压强小于C点,压强越大,反应速率越大,所以反应速率A<C,故A错误;
B.增大压强平衡逆向移动,但C点二氧化氮浓度大于A点,所以颜色A点浅、C点深,故B错误;
C.由状态B到状态A,压强不变,该反应的正反应是吸热反应,升高温度二氧化氮含量增大,则应该升高温度,故C正确;
D.化学平衡常数只与温度有关,A、C点温度相同则平衡常数相同,故D错误;
故选C;(5)将方程式 ![]() 得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣
得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣ ![]() kJ/mol=﹣867kJ/mol,
kJ/mol=﹣867kJ/mol,
所以答案是:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol.
【考点精析】解答此题的关键在于理解化学平衡状态的判断的相关知识,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)═SiO2(s)△H=﹣989.2kJmol﹣1 , 有关键能数据如表:
化学键 | Si﹣O | O═O | Si﹣Si |
键能/kJmol﹣1 | x | 498.8 | 176 |
(1)已知1mol Si中含2mol Si﹣Si键,1mol SiO2中含4mol Si﹣O键,则x的值为
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等.硅光电池是一种把 能转化为 能的装置.
(3)假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是 (填字母).
A、硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B、硅的来源丰富,易于开采,且可再生
C、硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D、寻找高效新催化剂,使硅的生产耗能很低,是硅能源开发利用的关键技术
(4)工业制备纯硅的反应为2H2(g)+SiCl4(g)═Si(s)+4HCl(g)△H=+240.4kJmol﹣1 , 生成的HCl通入100mL 1molL﹣1的NaOH溶液恰好反应,则反应过程中 (填“吸收”或“释放”)的热量为 kJ.
【题目】某学生用0.10molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
(1)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定前平视读数,终点读数时仰视读数
B.锥形瓶水洗后未用用标准盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若在达到滴定终点时,不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL)继续加水到50mL,所得溶液的PH为
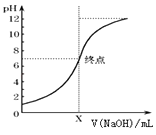
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图象,当滴加NaOH溶液为10mL时,该混合液的PH= , (含Lg表达式),若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
(4)氧化还原滴定﹣﹣取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1molL﹣1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.表格中记录了实验数据:
数 | 待测液体积 | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 23.40 |
第二次 | 25.00 | 4.00 | 23.90 |
第三次 | 25.00 | 5.00 | 25.10 |
①滴定时,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为