��Ŀ����
����Ŀ���ڼס��ҡ���������ͬ�ܱ������а���ͬ��ʽͶ�ϣ�һ�������·�����Ӧ(��ʼ�¶Ⱥ���ʼ�����ͬ):N2(g)+3H2(g)![]() 2NH3(g) ��H<0������������±���ʾ:
2NH3(g) ��H<0������������±���ʾ:
���� | �� | �� | �� |
������� | ���º��� | ���Ⱥ��� | ���º�ѹ |
��Ӧ��Ͷ�� | lmolN2��3molH2 | 2molNH3 | 2molNH3 |
ƽ��ʱ������� | V�� | V�� | V�� |
��Ӧ��ƽ�ⳣ��K | K�� | K�� | K�� |
ƽ��ʱNH3��Ũ��/mol/L | c�� | c�� | c�� |
ƽ��ʱNH3�ķ�Ӧ����/mol/(L��min) | v�� | v�� | v�� |
����˵����ȷ����
A. V��>V�� B. K��>K�� C. c��>c�� D. V��=V��
���𰸡�BC
�����������ס��ҡ������Ǻ��º����������ҡ�������ʼ�����2molNH3���ü�����һ�ߵ��������Ϊ1molN2��3molH2������ж�Ӧ��ȣ���ﵽƽ��ʱ�ס��ҡ�������ȫȫ�ȵĵ�Чƽ�⡣A�����÷�Ӧ������Ӧ�������������С�ķ�Ӧ����Ϊ���º�ѹ��������ƽ�⣬������������V��![]() V��������B��÷�Ӧ������ӦΪ���ȷ�Ӧ����Ϊ���Ⱥ�����������ƽ�⣬�����¶Ƚ��ͣ������¶�ƽ��������Ӧ�����ƶ���Kֵ����K��
V��������B��÷�Ӧ������ӦΪ���ȷ�Ӧ����Ϊ���Ⱥ�����������ƽ�⣬�����¶Ƚ��ͣ������¶�ƽ��������Ӧ�����ƶ���Kֵ����K��![]() K������ȷ��C��÷�Ӧ������ӦΪ���ȷ�Ӧ����Ϊ���Ⱥ�����������ƽ�⣬�����¶Ƚ��ͣ����൱���ڼ״ﵽƽ��ʱ�����¶ȣ�ƽ��������Ӧ�����ƶ�����c��
K������ȷ��C��÷�Ӧ������ӦΪ���ȷ�Ӧ����Ϊ���Ⱥ�����������ƽ�⣬�����¶Ƚ��ͣ����൱���ڼ״ﵽƽ��ʱ�����¶ȣ�ƽ��������Ӧ�����ƶ�����c��![]() c������ȷ��D��÷�Ӧ������Ӧ�������������С�ķ�Ӧ����Ϊ���º�ѹ��������ƽ�⣬������������V��
c������ȷ��D��÷�Ӧ������Ӧ�������������С�ķ�Ӧ����Ϊ���º�ѹ��������ƽ�⣬������������V��![]() V��������ѡBC��
V��������ѡBC��

 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�����Ŀ����ȥ���������е����ʣ������ڵ����ʣ�����ʹ�õ��Լ�����Ҫ��������ȷ���ǣ�������
ѡ�� | ���� | ʹ�õ��Լ� | ��Ҫ���� |
A | �Ҵ���ˮ�� | ������ | ���� |
B | �������������ᣩ | ����̼������Һ | ��Һ |
C | �������ӣ� | Ũ��ˮ | ���� |
D | ���飨��ϩ�� | ���Ը��������Һ | ϴ�� |
A.A
B.B
C.C
D.D
����Ŀ���ݡ��ο���Ϣ���������п�ѧ��������ǡ�21���͵���Դ������δ����ʯ�͡��Ĺ۵㣨1���������������ȼ�յ��Ȼ�ѧ����ʽΪSi��s��+O2��g���TSiO2��s����H=��989.2kJmol��1 �� �йؼ������������
��ѧ�� | Si��O | O�TO | Si��Si |
����/kJmol��1 | x | 498.8 | 176 |
��1����֪1mol Si�к�2mol Si��Si����1mol SiO2�к�4mol Si��O������x��ֵΪ
��2���������Ϊ��Դ�ѹ㷺Ӧ�����������ǡ���������������վ�ȣ��������һ�ְ� ��ת��Ϊ �ܵ�װ�ã�
��3���������Ϊһ���ձ�ʹ�õ�������Դ���������ã��������������ص�����˵���У�����Ϊ�������� ������ĸ����
A����������䡢���棬�Ӱ�ȫ�Ƕȿ��ǣ�������ѵ�ȼ��
B�������Դ�ḻ�����ڿ��ɣ��ҿ�����
C����ȼ�շų�����������ȼ�ղ���Ի�����Ⱦ�̶ȵͣ�������Ч����
D��Ѱ�Ҹ�Ч�´�����ʹ����������ܺܵͣ��ǹ���Դ�������õĹؼ�����
��4����ҵ�Ʊ�����ķ�ӦΪ2H2��g��+SiCl4��g���TSi��s��+4HCl��g����H=+240.4kJmol��1 �� ���ɵ�HClͨ��100mL 1molL��1��NaOH��Һǡ�÷�Ӧ����Ӧ������ ������ա����ͷš���������Ϊ kJ��
����Ŀ��ijѧ����0.10molL��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬȡ20.00mL����ϡ������Һ������ƿ�У����μ�2��3�η�̪��ָʾ�����ظ������ζ�����2��3 �Σ���¼�������£�
��1��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ��� ��
A.�ζ�ǰƽ�Ӷ������յ����ʱ���Ӷ���
B.��ƿˮϴ��δ���ñ�������ϴ
C.��ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���������Һ��ϴ
D.��Һ©������ƿ��һ��
E.�ζ�ǰ���Ӷ������յ�ζ����Ӷ���
F.��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ
��2�����ڴﵽ�ζ��յ�ʱ�����������һ��NaOH��Һ��һ����Һ���ԼΪ0.05mL��������ˮ��50mL��������Һ��PHΪ
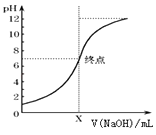
��3����ͼ����20mL������������0.1mol/L NaOH��Һʱ����Һ��pH�仯ͼ���μ�NaOH��ҺΪ10mLʱ���û��Һ��PH= �� ����Lg����ʽ�������ø�NaOH��Һ�ζ�δ֪Ũ�ȵ�CH3COOH��Һ����Ӧǡ����ȫʱ��������������ȷ����
A����Һ�����ԣ���ѡ�ü��Ȼ��̪��ָʾ�� B����Һ�����ԣ�ֻ��ѡ��ʯ����ָʾ��
C����Һ�ʼ��ԣ���ѡ�ü��Ȼ��̪��ָʾ�� D����Һ�ʼ��ԣ�ֻ��ѡ�÷�̪��ָʾ��
��4��������ԭ�ζ�����ȡ������Һ������ƿ�У���������ϡ���ᣬ��Ũ��Ϊ0.1molL��1�ĸ��������Һ�ζ��������ķ�ӦΪ��2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O�������м�¼��ʵ�����ݣ�
�� | ����Һ��� | ��KMnO4��Һ�����mL�� | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 25.00 | 0.50 | 23.40 |
�ڶ��� | 25.00 | 4.00 | 23.90 |
������ | 25.00 | 5.00 | 25.10 |
�ٵζ�ʱ���ζ��յ�ʱ�ζ�������
�ڸò�����Һ�����ʵ���Ũ��Ϊ