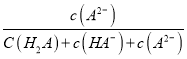题目内容
【题目】对氧化还原反应:11P+15CuSO4+24H2O→5Cu3P+6H3PO4+15H2SO4,下列说法正确的是
A.5/11的磷被氧化
B.3mol CuSO4可氧化11/5mol P
C.每摩尔起氧化作用的磷能氧化磷生成磷酸的物质的量为0.6mol
D.当1mol P参加反应时,转移电子的物质的量为3 mol
【答案】C
【解析】
A. 11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,P元素的化合价由0降低为-3价,这样的P原子是5mol,还有P元素的化合价由0升高为+5价,这样的P原子是6mol,即被氧化的磷原子为![]() ,选项A错误;
,选项A错误;
B.根据反应知道,是1molCuSO4得到1mol电子,1molP失去5mol电子,则3molCuSO4可氧化0.6molP,选项B错误;
C.起氧化作用P元素的化合价由0降低为-3价转移3个电子,起还原作用的P的化合价由0升高为+5价转移5个电子,则每摩尔起氧化作用的磷能氧化磷生成磷酸的物质的量为0.6mol,选项C正确;
D.当1molP参加反应时,有![]() molP作还原剂,转移电子的物质的量为
molP作还原剂,转移电子的物质的量为![]() mol,选项D错误.
mol,选项D错误.
答案选C。

【题目】结晶硫酸亚铁部分失水时,分析结果如仍按FeSO4·7H2O的质量分数计算,其值会超过100%。国家标准规定,FeSO4·7H2O的含量:一级品99.50%~100.5%;二级品99.00%~100.5%;三级品98.00%~101.0%。
为测定样品中FeSO4·7H2O的质量分数,可采用在酸性条件下与高锰酸钾溶液进行滴定。
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O;
2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O
测定过程:粗配一定浓度的高锰酸钾溶液1L,然后称取0.200 g 固体Na2C2O4(式量为134.0)放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70℃~80℃。
(1)若要用滴定法测定所配的高锰酸钾溶液浓度,滴定终点的现象是_______________。
(2)将溶液加热的目的是____;反应刚开始时反应速率较小,其后因非温度因素影响而增大,根据影响化学反应速率的条件分析,其原因可能是______________________。
(3)若滴定时发现滴定管尖嘴部分有气泡,滴定结束气泡消失,则测得高锰酸钾浓度_____(填“偏大”“偏小”“无影响”)。
(4)滴定用去高锰酸钾溶液29.50mL,则c(KMnO4)=_____mol/L(保留四位有效数字)。
(5)称取四份FeSO4·7H2O试样,质量均为0.506g,,用上述高锰酸钾溶液滴定达到终点,记录滴定数据
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
V(高锰酸钾)/mL(初读数) | 0.10 | 0.20 | 0.00 | 0.20 |
V(高锰酸钾)/mL(终读数) | 17.76 | 17.88 | 18.16 | 17.90 |
该试样中FeSO4·7H2O的含量(质量分数)为_________(小数点后保留两位),符合国家______级标准。
(6)如实际准确值为99.80%,实验绝对误差=____%,如操作中并无试剂、读数与终点判断的失误,则引起误差的可能原因是:__________。