题目内容
【题目】火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式:_________________。
(2)脱碳。
方法一:在恒容密闭容器中将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①下列条件可以判定该反应到达平衡状态的是_________(填字母)。
A.2v正(H2)=v逆(CH3OH) B.容器内气体的密度不变
C.容器内压强不变 D.反应不再释放热量
方法二:让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:

②图中p1、p2、p3的大小关系是_________________,图中a、b、c三点对应的平衡常数Ka、Kb、Kc大小关系是____________。
③900℃、1.013MPa时,1molCO2与足量碳反应达平衡后容器的体积为V L,CO2的转化率为______(保留一位小数),该反应的平衡常数K=_________。
方法三:用NaOH溶液吸收CO2。
④在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO32-):c(CO32-)=4:1,此时溶液的pH=_______。(已知:室温下,H2CO3的K1=4×10-7,K2=5×10-11。lg2=0.3)
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成(NH4)2SO4。(NH4)2SO4水溶液呈酸性的原因是_______________(用离子方程式表示);室温时,向(NH4)2SO4溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)____c(NH3·H2O)(填“>”、“<”或“=”)。
【答案】CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol CD p1<p2<p3 Ka=Kb<Kc 66.7% ![]() mol/L 9.7 NH4++H2O
mol/L 9.7 NH4++H2O![]() NH3·H2O+H+ =
NH3·H2O+H+ =
【解析】
(1)CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol ①
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol ②
将(①+②)÷2,即得CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式。
(2)①A.速率之比不等于化学计量数之比;
B.不管反应是否达平衡,容器内气体的密度始终不变;
C.因为反应前后气体分子数不等,所以平衡前,容器内压强始终改变;
D.反应不再释放热量,则表明反应达平衡状态。
②因为反应物的气体分子数小于生成物的气体分子数,所以减小压强,CO的体积分数[φ(CO)%]增大,由此可得出图中p1、p2、p3的大小关系;由图中温度与CO的体积分数[φ(CO)%]关系,可确定正反应为吸热反应,温度升高,平衡常数增大,由此可确定Ka、Kb、Kc大小关系。
③900℃、1.013MPa时,φ(CO)%=80%,建立三段式,可求出CO2的转化率和该反应的平衡常数K。
④在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO32-):c(CO32-)=4:1,此时溶液中存在平衡CO32-+H2O![]() HCO3-+OH-,Kb=
HCO3-+OH-,Kb=![]() =
=![]() ,代入数据即可求出c(OH-),从而求出pH。
,代入数据即可求出c(OH-),从而求出pH。
(3)(NH4)2SO4为强酸弱碱盐,NH4+水解使溶液呈酸性;室温时,向(NH4)2SO4溶液中滴入NaOH溶液至溶液呈中性,则反应生成NaNH4SO4和NH3H2O,且NH4+不水解,NH3H2O不电离,由此可得出c(Na+)与c(NH3·H2O)的关系。
(1)CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol ①
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol ②
将(①+②)÷2,即得CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式为CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol。答案为:CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol;
(2) ①A.速率之比不等于化学计量数之比,不是平衡状态,A不合题意;
B.不管反应是否达平衡,容器内气体的密度始终不变,则密度不变时不一定是平衡状态,B不合题意;
C.因为反应前后气体分子数不等,所以平衡前,容器内压强始终改变,压强不变,说明反应达平衡,C符合题意;
D.反应不再释放热量,则表明反应达平衡状态,D符合题意。答案为:CD。
②因为反应物的气体分子数小于生成物的气体分子数,所以相同温度时,减小压强,CO的体积分数[φ(CO)%]增大,由图中CO的体积分数[φ(CO)%]关系,可确定p1、p2、p3的大小关系为p1<p2<p3;由图中温度与CO的体积分数[φ(CO)%]关系,可确定正反应为吸热反应,温度升高,平衡常数增大,由此可确定Ka、Kb、Kc大小关系为Ka=Kb<Kc。答案为:p1<p2<p3;Ka=Kb<Kc;
③设CO2的变化量为x
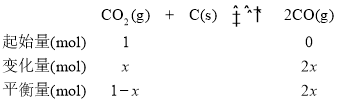
![]() ,x=
,x=![]() mol。
mol。
α(CO2)%=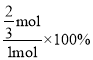 = 66.7%,K=
= 66.7%,K=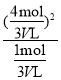 =
=![]() mol/L。答案为:66.7%;
mol/L。答案为:66.7%;![]() mol/L;
mol/L;
④在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO32-):c(CO32-)=4:1,此时溶液中存在平衡CO32-+H2O![]() HCO3-+OH-,Kb=
HCO3-+OH-,Kb=![]() =
=![]() ,代入数据即可求出c(OH-)=5×10-5mol/L,c(H+)=2×10-10mol/L,从而求出pH=10-lg2=9.7。答案为:9.7;
,代入数据即可求出c(OH-)=5×10-5mol/L,c(H+)=2×10-10mol/L,从而求出pH=10-lg2=9.7。答案为:9.7;
(3)(NH4)2SO4为强酸弱碱盐,NH4+水解使溶液呈酸性,离子方程式为NH4++H2O![]() NH3H2O+H+;室温时,向(NH4)2SO4溶液中滴入NaOH,发生反应为(NH4)2SO4+NaOH=NaNH4SO4+NH3H2O,溶液呈中性,则NH4+不水解,NH3H2O不电离,由此可得出c(Na+)=c(NH3·H2O)。答案为:NH4++H2O
NH3H2O+H+;室温时,向(NH4)2SO4溶液中滴入NaOH,发生反应为(NH4)2SO4+NaOH=NaNH4SO4+NH3H2O,溶液呈中性,则NH4+不水解,NH3H2O不电离,由此可得出c(Na+)=c(NH3·H2O)。答案为:NH4++H2O![]() NH3H2O+H+;=。
NH3H2O+H+;=。



